产单核细胞李氏杆菌噬菌体分离、超离、宿主谱鉴定及生长曲线绘制(二)
2结果
2.1产单核细胞李氏杆菌噬菌体的分离
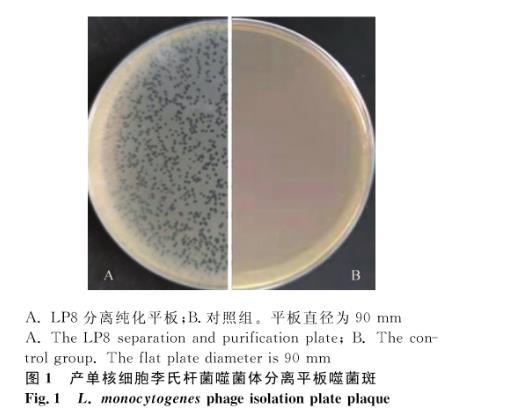
利用本实验室保存的产单核细胞李氏杆菌作为宿主菌,对采集的所有污水样品利用双琼脂平板法进行分离,分离出若干株噬菌体,选取一株性状优良、传代稳定的噬菌体进行后续试验,并命名为LP8,宿主菌编号为ATCC19111(1/2a),平板上可以观察到明显的噬菌斑,噬菌斑形状规整,边缘整齐,颜色透亮,直径2 mm左右,纯化传代稳定,无晕环(图1)。
2.2噬菌体超离
利用氯化铯密度梯度离心法对LP8噬菌体浓缩液进行超离,在密度为1.50~1.70 g·mL的氯化铯溶液梯度之间具有噬菌体层,吸取噬菌体超离液,通过效价核定,效价为4.4×10PFU·mL。
2.3噬菌体电镜观察
利用透射电镜对LP8样品进行观察,发现LP8为肌尾科噬菌体,具有标准的20面体的头部,还有一个由中空的针状结构和鞘组成的尾部,以及尾针组成的基部,噬菌体的头部直径约为80 nm;尾部长度约为120 nm(图2)。

2.4 LP8噬菌体效价的测定
对LP8噬菌体的裂解液、浓缩液、超离液进行效价测定,结果分别为1.76×10、2.67×10、4.4×10PFU·mL。
2.5 LP8噬菌体宿主谱鉴定
利用实验室所保存的产单核细胞李氏杆菌、威尔斯李氏杆菌和英诺克李氏杆菌对LP8噬菌体进行宿主谱鉴定,结果显示LP8噬菌体对18株LM都具有裂解性,对5株威尔斯李氏杆菌(C10、9-2、4-40、C59、4-43)具有裂解性,对22株英诺克李氏杆菌均无裂解性(表1)。
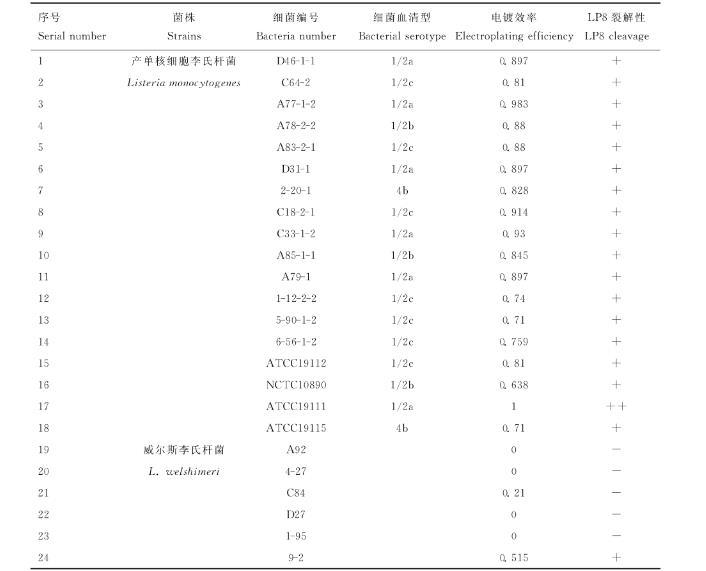
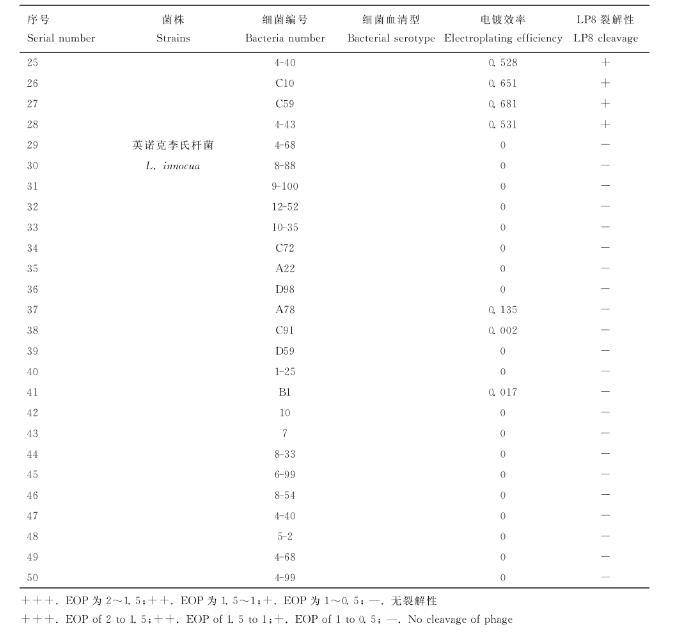
表1 LP8噬菌体宿主谱
2.6 LP8噬菌体生长特性
对LP8设置不同的感染比例,测定出LP8的MOI为1(图3A);设置25、35、45、55、65、75℃温度梯度,确定LP8的最适温度为45℃(图3B);设置pH为2、4、6、7、8、10、12梯度,确定LP8的最适pH为7(图3C);采用的6种有机溶剂中,氯仿和异戊醇对LP8影响最大,可造成LP8全部失活,丙三醇和SM空白对照组没有影响,甲醇和乙醇会导致噬菌体部分失活(图3D);绘制一步生长曲线,确定LP8潜伏期为23 min,对数期为23~80 min,80 min以后达到平台期,噬菌体效价最大可达到3.4×10PFU·mL(图3E)。
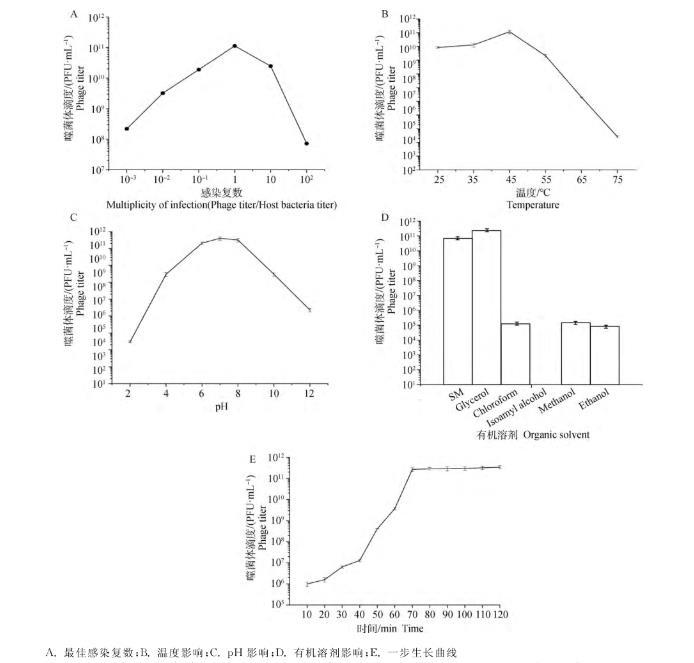
A.最佳感染复数;B.温度影响;C.pH影响;D.有机溶剂影响;E.一步生长曲线
2.7 LP8基因组酶切鉴定
电泳条带显示,噬菌体LP8基因组在1、2号DNA酶泳道未出现条带,在3、4号RNA泳道和5、6号绿豆核酸酶泳道都出现了条带,根据条带结果得出噬菌体基因组为双链DNA(图4)。
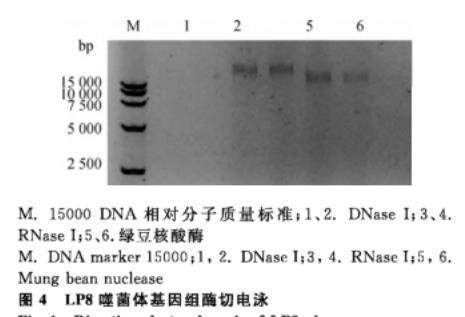
M.15000 DNA相对分子质量标准;1、2.DNase I;3、4.RNase I;5、6.绿豆核酸酶
2.8 LP8基因组测序
经测序,噬菌体LP8的基因组为87 038 bp,共有120个编码基因,编码基因的累加长度为76 326 bp、编码基因的平均长度为636 bp、编码区域长度占基因组的比例为87.69%。通过SnapGene软件对全基因组进行绘图,分析其基因的大小和分布情况。通过COG、KEGG、GO对LP8的基因进行注释,发现有6个编码基因参与原噬菌体合成;有20个编码基因参与噬菌体有关的生物过程;11个编码基因参与分子功能,如结合或催化;8个编码基因参与噬菌体的合成,具体生物学通路最多的为嘌呤代谢和嘧啶代谢(图5)。
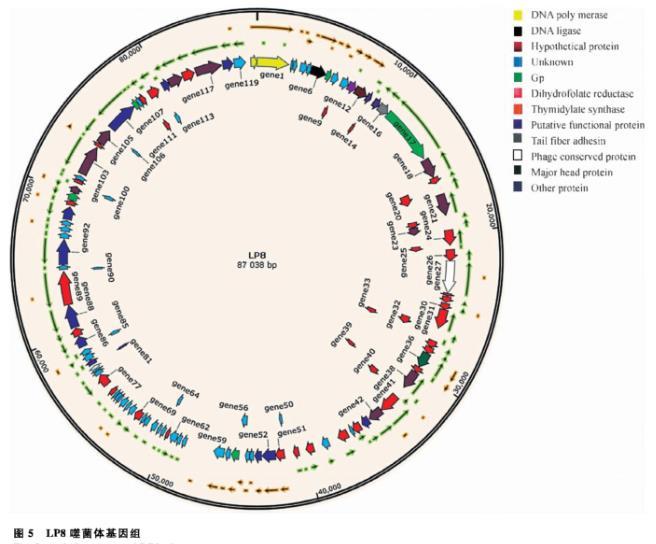
图5 LP8噬菌体基因组
相关新闻推荐
2、Y群脑膜炎奈瑟菌对13种抗菌药物敏感性试验——摘要、材料与方法
