发根农杆菌Ri质粒构建灯盏花发根最优的培养体系(二)
1.2.3叶盘法转化
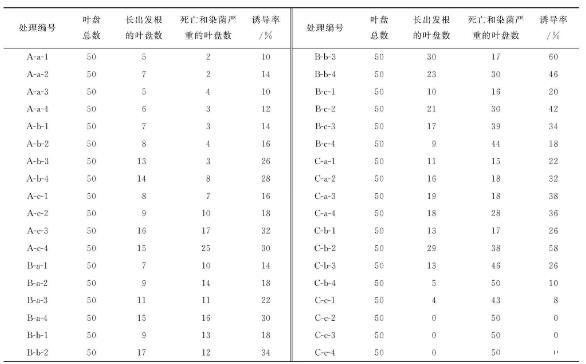
将灯盏花无菌苗叶片剪成约0.5 cm2大小的叶盘,分别置于B5、1/2B5、1/2MS、MS固体空白培养基上25℃恒温暗培养2 d(预培养)。将部分叶盘不作农杆菌浸染处理,以作对照。其余预培养后的叶盘分别放入制备好的OD600为0.4、0.6、0.8的3种浓度的农杆菌菌液中,分别浸染5、10、15 min,捞出后吸干残留菌液。再分别放回预培养时的B5、1/2B5、1/2MS、MS固体培养基,25℃,分别无光恒温共培养0、1、2、3 d。之后将共培养的叶盘对应转到含500 mg/L头孢噻污钠(Cef)的B5、1/2B5、1/2MS、MS固体培养基,25℃无光恒温除菌培养10~15 d后,一般可看到叶盘边缘伤口处有发根长出,待发根长至2~3 cm后将其剪下,分别对应在新的含500 mg/L Cef及10 mg/L潮霉素B(Hyb)的B5、1/2B5、1/2MS、MS固体培养基上进行除菌筛选培养,每15~20 d更换1次培养基。每更换1次培养基,培养基其他成分不变,抗生素Cef浓度按500 mg/L→300 mg/L→100 mg/L→0 mg/L阶梯性降低,直至除菌完全。
最后统计比较不同菌液浓度(处理A—OD600=0.4;B—处理OD600=0.6;C—处理OD600=0.8)、不同浸染时间(处理a—5 min;处理b—10 min;处理c—15 min)和不同共培养时间(处理1—0 d;处理2—1 d;处理3—2 d;处理4—3 d)对叶盘发根诱导率、叶盘死亡率及染菌率等的影响,从而得出灯盏花发根最佳诱导培养条件。
1.2.4发根鉴定
取在除菌筛选培养基上仍生长良好的发根约100 mg,采用CTAB法提取总DNA,以总DNA为样品模板,同时以C58C1菌为阳性对照,以非转化根DNA为阴性对照,PCR鉴定毛状根总DNA中是否含发根农杆菌C58C1 Ri质粒的rolB和rolC基因:1)primers forrolB:rolB-F:5′-CGA GGG GAT CCG ATT TGC TT-3′;rolB-R:5′-GAC GCC CTC CTC GCC TTC CT-3′。2)primers forrolC:rolC-F:5′-TCG CCA TGC CTC ACC AAC TCA C-3′;rolC-R:5′-CCT TGA TCG AGC CGG GTG AGA A-3′。3)反应体系(20μL):ddH2O 7μL,Template DNA 1μL,Forward Primer(10μmol/L)1μL,Reverse Primer(10μmol/L)1μL,2×rTaq PCR SuperMix 10μL。4)PCR反应程序:94℃5 min;94℃30 s,55℃30 s,72℃40 s,35个循环;72℃5 min。凝胶成像系统下观察DNA条带。
1.2.5液体振荡扩大培养
选取除菌完全且鉴定为阳性的发根,剪取约300 mg,分别放入装有200 mL B5、1/2B5、1/2MS、MS液体培养基的三角瓶,置于摇床上,25℃避光,100 r/min振荡培养,每周更换1次培养基并称质量,比较不同培养基对发根生长速率的影响。
2结果与分析
结果显示,对照组未经农杆菌浸染诱导处理的叶盘也有极少部分长出了不定根。灯盏花发根诱导流程见图1。经农杆菌浸染处理的试验组叶盘,因培养条件不同,表现出了不同的诱导率。具体诱导率见表1。
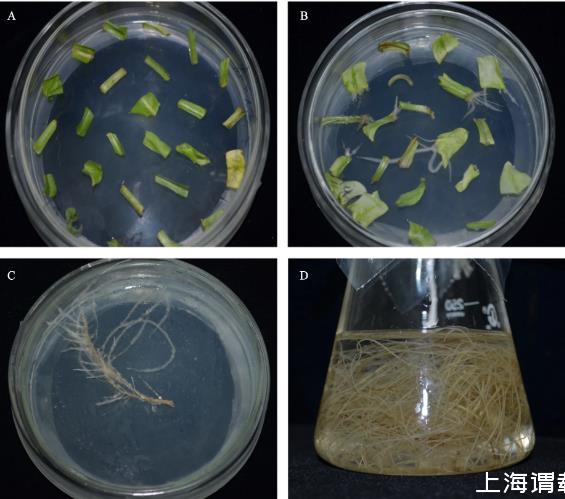
A.叶盘预培养;B.诱导;C.除菌筛选培养;D.液培
图1灯盏花发根诱导流程
注:为方便统计,表中所述长出发根的叶盘数是指凡是叶盘边缘长出了根的叶盘的数量,这些根不一定是发根,因此,诱导率也并不一定是阳性诱导率;死亡和染菌严重的叶盘数指培养过程中黄化死亡未能长出发根的,及虽长出了发根但染菌严重,无法脱菌完全的叶盘总数。
2.1发根的鉴定
按上述发根鉴定方法对脱菌完全的发根提取DNA进行PCR鉴定,其中对照组绝大部分在除菌筛选培养时已黄化死亡,少数存活的不定根PCR鉴定也均不含rolB、rolC基因,因此不是发根。试验组则大部分是有rolB、rolC基因的阳性发根。PCR鉴定结果如图2。阳性发根则于液体培养基中扩大培养。

M:T-2000 DNA Maker;N:阴性对照;P:阳性对照;1~10:样品
图2发根中rolB、rolC基因PCR鉴定结果
相关新闻推荐
2、重金属胁迫培养对大肠杆菌和枯草芽孢杆菌生长曲线的影响(一)
3、枯草芽孢杆菌LBD-1形态特征、生长曲线、抗逆性及发酵后饲料特性(三)
