土霉素菌渣无害化处理:筛选菌株的生长曲线及产蛋白酶条件(一)
2.5.2培养温度对菌株产蛋白酶能力的影响
向100 mL/250 mL察氏培养基中,分别接入1 mL M-1、M-2孢子悬液,pH值为6.5,培养温度分别设置为25℃、30℃、35℃、40℃、45℃,平行3组。在转速为160 r/min条件下培养168 h,分别取样,测定酶活,考察温度的变化对产酶活性的影响,结果如图6。
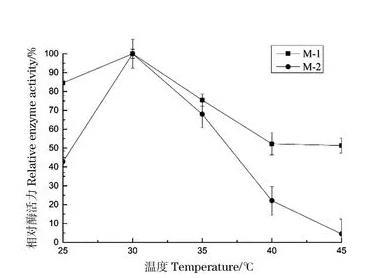
图6培养温度对菌株产酶的影响
在30℃以下培养时,菌株M-1和M-2产生蛋白酶活力随着温度的升高而增大,温度达到30℃时,它们酶活力均达到最高,而后随温度的提高酶活力下降。因此,菌株M-1和M-2产蛋白酶的最适温度确定为30℃。
2.5.3培养时间对菌株产酶的影响
分别向100 mL/250 mL察氏培养基中接入1 mL M-1孢子悬液、1 mL M-2孢子悬液,pH值为6.5,平行3组。在30℃转速为160 r/min条件下培养192 h。每隔24 h分别取样测定酶活,考察培养时间对产酶活性的影响,结果如图7。
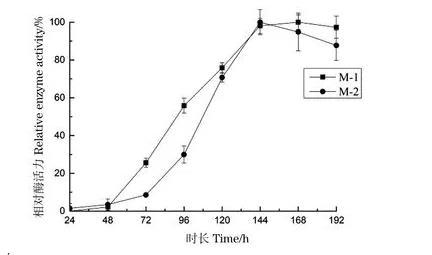
图7培养时间对菌株产酶的影响
培养到48 h时,菌株M-1、M-2均开始产蛋白酶,培养至72 h时,酶积累量开始增大。在168 h时M-1产酶活力达到最高值,而M-2在144 h时酶活达到最高;在最高点之后,两种菌的产酶活性随之缓慢下降。因此,菌株M-1和M-2产蛋白酶的最适培养时间分别确定为168 h和144 h。
2.5.4菌渣添加量对菌株产蛋白酶能力的影响
分别在100 mL/250 mL蒸馏水中加入5、10、15、20、25 g的400目土霉素菌渣粉末,分别向其中接入1 mL M-1、M-2孢子悬液,平行3组。在pH 6.5,转速为160 r/min,30℃条件下培养144 h,分别测定酶活,考察菌渣添加量对产酶活性的影响,结果如图8。
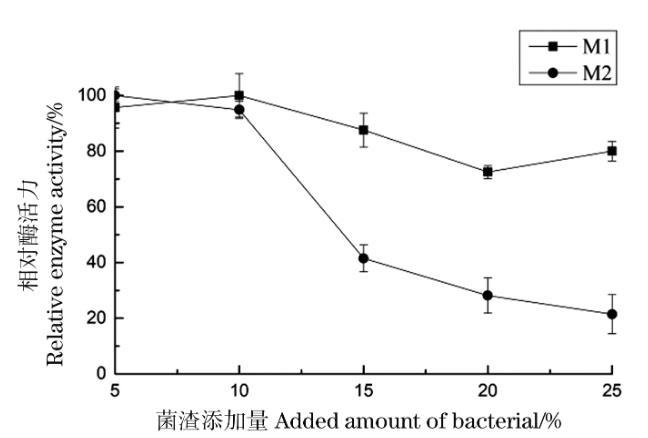
图8菌渣添加量对菌株产酶的影响
菌渣添加量为5%~10%,M-1产蛋白酶的活力随菌渣添加量的增大而增加,10%达到最高。M-2产蛋白酶活力在5%时达到最高,在10%时也保持了较高的酶活力。随后,两种菌的酶活力随着菌渣添加量的增大而快速下降。在菌株M-1和M-2产蛋白酶的培养基中添加过多菌渣不利于其产生蛋白酶,这可能是菌渣中的一些成分影响了菌的产酶活性。所以,菌株M-1和M-2在菌渣培养基产蛋白酶的最适菌渣添加量分别确定为10%和5%。
2.5.5接种量对菌株产蛋白酶能力的影响
在100 mL/250 mL 5%的菌渣培养基中,分别接种1、3、5、7和9 mL的M-1、M-2孢子悬液,平行3组。在pH 6.5,转速为160 r/min,30℃条件下培养144 h,分别取样测定酶活,考察接种量对产酶活性的影响,结果如图9。
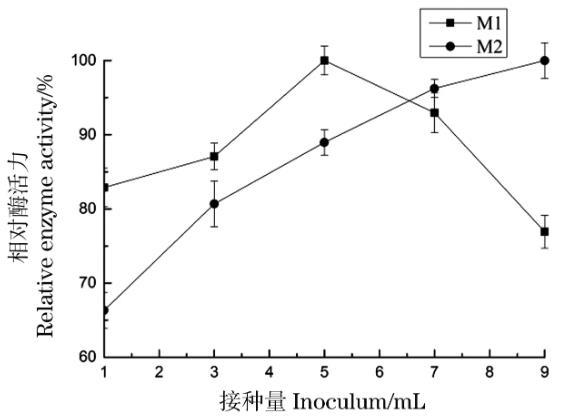
图9接种量对菌株产酶的影响
菌株M-1的产蛋白酶活力随接种量的提高而增加,直至接种量为5 mL时其酶活力达到最高值,随后其产酶活力逐渐下降,这可能是因为增加初始菌体的量导致菌体生长加快、发酵周期缩短。菌株M-2开始时,随着接种量的加大其蛋白酶活力逐渐增加。所以,菌株M-1和M-2在菌渣培养基中产蛋白酶的最适接种量分别确定为5%和9%。
2.5.6装液量对菌株产蛋白酶能力的影响
在250 mL的锥形瓶中分别加入5%的菌渣培养基20、40、60、80和100 mL,分别按照5%和9%的接种量接入M-1、M-2的孢子悬液,平行3组。在pH 6.5,转速为160 r/min,30℃条件下培养144 h,分别取样测定酶活,考察装液量对产酶活性的影响,结果如图10。
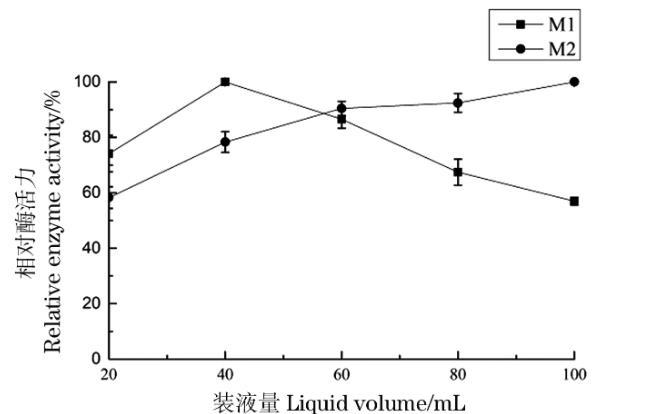
图10装液量对菌株产酶的影响
菌株M-1在装液量低于40 mL时,其产生蛋白酶活力随装液量的加大而增加,在装液量为40 mL时酶活达到最高,而后其酶活下降。菌株M-2的产蛋白酶活力随着装液量的增加而逐渐提高。所以,在250 mL锥形瓶中,M-1、M-2的最佳装液量确定为40 mL和100 mL。
2.6菌株在优化菌渣培养条件下的产蛋白酶活力测定
M-1的优化培养条件:在250 mL锥形瓶中,40 mL装液量,10%菌渣添加量,5%接种量,pH值6.0,30℃,摇床转速160 r/min培养168 h;M-2的优化培养条件:在250 mL锥形瓶中,100 mL装液量,5%菌渣添加量,9%接种量,pH值6.5,30℃,摇床转速160 r/min培养144 h。发酵结束后,测定蛋白酶活力。结果见表1。

表1筛选菌株产蛋白酶活力
在菌渣培养基中,菌株M-2在其最适产酶条件下,发酵上清液中蛋白酶活为44.41 u/mL,菌株M-1在其最适产酶条件下产蛋白酶活性达到99.33 u/mL,比菌株M-2的高出1.24倍。
2.7筛选菌株对土霉素菌渣的转化
筛选菌株对菌渣成分的转化研究中,共考察了菌渣总重量、蛋白成分的变化和发酵后游离氨基酸的变化等内容,结果见表2。

表2菌渣活性成分的变化
菌株M-1和M-2在菌渣培养基中进行发酵时,对菌渣成分能够有效转化;其中M-1对总物质的转化率达到6.21%,其中对菌渣蛋白质成分转化尤为明显达到12.79%;菌渣经M-1发酵处理后其游离氨基酸含量有明显的提升,由原来7.14 mg增加到222.07 mg,提高了30倍。结果表明,筛选菌株M-1在简单的菌渣培养基中能很好地生长,而且对菌渣蛋白质有较好的水解和转化活性。菌株M-2对菌渣总物质的转化率达到2.4%,对菌渣蛋白质成分转化达到3.65%,菌渣经M-2发酵处理后其游离氨基酸含量有较好的提升,由原来7.14 mg增加到49.26 mg,提高了6倍。经M-1处理后的菌渣所减少的质量大部分是蛋白质被转化所致,而M-2处理后的菌渣减少的质量部分是转化蛋白质,另外一部分是被水解的其他物质减少的量。
3结论
本实验筛选出两株M-1、M-2,经初步鉴定M-1为米曲霉菌,M-2为绿色木霉菌。M-1在pH 3、M-2在pH 6.5时生长量最大,均表现出良好的酸耐受性。两株霉菌在土霉素浓度1 800 u/mL的条件下生长良好,具有较好的土霉素耐受性。菌渣pH值及土霉素残留量对其生长没有抑制作用,适合应用于土霉素菌渣的处理,对碱性环境耐受性较差。两株霉菌对处理菌渣是有效的,M-1的处理效果好于M-2。M-1对菌渣蛋白质成分的转化率达到12.79%,游离氨基酸含量提高了30倍;菌渣经M-2发酵处理后其游离氨基酸含量提高了6倍。
筛选菌株可在酸性的菌渣环境中生长,可对生产菌渣进行发酵处理,可以得到蛋白质水解液,用水解液部分替代土霉素生产发酵培养基的碳、氮源进行生产土霉素,可降低生产成本;同时达到菌渣的回收利用和无害化处理目的。对含大量抗生素残留、成分复杂、难降解的危险污染物菌渣,目前还缺乏高效、节能、环境友好型的处理方法。土霉素菌渣中的蛋白质含量可达到43.88%,利用两株霉菌生长及代谢的不同,如果实现两种菌株的混合培养,作为互补进而加强对菌渣的处理能力,对危险菌渣的无害化处理及资源的再利用方面具有重大价值,这有待进一步研究。
土霉素菌渣无害化处理:筛选菌株的生长曲线及产蛋白酶条件(一)
土霉素菌渣无害化处理:筛选菌株的生长曲线及产蛋白酶条件(二)
