犬奇异变形杆菌及其噬菌体分离鉴定、生长曲线及药敏试验(二)
1.2.3细菌脲酶鉴定
参照W.B.Christensen等的试验方法,将分离纯化的细菌接种于尿素培养基上,37℃恒温培养10~12 h后,观察尿素培养基颜色变化。尿素培养基由橘黄色变红色则表明细菌能够产生尿素酶。
1.2.4 16 Sr R NA的扩增
参考细菌基因组提取试剂盒说明书提取细菌基因组DNA,稀释至浓度为20 ng·μL-1备用。设计细菌16S通用引物,引物序列为F5′-GAGTTTGATCCTGGCTCA-3′和R5′-GTTACCTTGTTACGACT-3′,预扩增片段大小约为1 500 bp。PCR扩增体系(总体积为50μL):Rnase-free 2×Taq Mix 25μL,引物各2μL,DNA模板2μL,H2O 19μL。扩增程序:94℃预变性90 s;94℃变性20 s,50℃退火20 s,72℃延伸90 s,30个循环;72℃再延伸5 min。使用DNA纯化回收试剂盒切胶纯化PCR产物,琼脂糖凝胶电泳观察条带大小无误后送到生工生物工程(上海)股份有限公司测序。测序结果与GenBank中其他序列进行比对分析。
1.2.5药敏试验
挑取单个菌落置于LB培养基,37℃培养6~8 h,取100μL菌液滴入LB固体培养基中涂布均匀,将不同的药敏纸片置于均匀涂满菌液的LB固体培养基中,37℃培养24 h,测量抑菌环直径,参照CLSI(2014)标准判定结果。
1.3噬菌体分离鉴定及生物学特性分析
1.3.1噬菌体的分离纯化及电镜观察
取未处理污水经纱布初滤大颗粒杂质后加入CaCl2终浓度为1 mmol·L-1,6 000 g离心15 min除去其他杂质。采用透析袋浓缩离心后的污水上清4℃过夜,浓缩后的污水经0.22μM滤膜过滤除菌、备用。以分离到的菌液为宿主菌分离噬菌体,将100 mL除菌的滤液上清加入100 mL 2×LB培养基,滴入对数生长期的宿主菌100μL,37℃160 r·min-1振荡培养12 h,10 000 g离心10 min,将上清经0.22μM滤器过滤除菌。将滤液和宿主菌充分混合,接种到融化的半固体培养基(琼脂含量0.75%)充分混匀,倒入营养琼脂平板中,凝固后置于37℃恒温培养8 h,观察噬菌斑的形成情况。挑取透明、形状规则的噬菌斑,采用双层平板法分离纯化8~10次,可以得到纯化的噬菌体。
为了进一步观察vB_PmM_XNR的形态,采用透射电镜(JEM-2100 Plus,JEOL,日本)观察。简要步骤:取噬菌体悬液10μL(106PFU·mL-1)置于铜网,静置20 min左右,用滤纸吸干多余液体,用负染液(2%磷钨酸溶液)染色5 min,滤纸吸干染液后,用蒸馏水清洗2遍,干燥后置于透射电镜(JEM-2100 Plus,JEOL,日本)观察。
1.3.2最佳感染复数测定及一步生长曲线
将细菌培养至对数生长期(约1×108CFU·mL-1),噬菌体与细菌各100μL,按照比例为100、10、1、0.1、0.01、0.001进行混合,室温静置10 min。37℃恒温160 r·min-1振荡培养4 h。双层平板法测定噬菌斑个数,以噬菌体滴度增加最高比例的为最佳感染复数,重复3次取均值。
将对数生长期的分离株(OD600=0.3,约为1×108CFU·mL-1)和噬菌体按MOI等体积(各500μL)混合后,置37℃静置孵育15 min,8 000 g离心5 min,弃上清。沉淀重悬于10 mL LB中,37℃摇床160 r·min-1振荡培养。每间隔5 min取样,测定不同时间点噬菌体滴度,绘制一步生长曲线。
1.3.3噬菌体温度和pH稳定性实验
将等体积噬菌体(108PFU·mL-1)分别置于不同温度(4、25、37、42、60和70℃)条件下孵育1 h后,采用双层平板法检测噬菌体滴度变化,评价噬菌体热稳定性。同样,将等体积的噬菌体分别加到不同pH(pH=2.0~12.0)的缓冲溶液中37℃水浴中孵育1 h,检测噬菌体滴度。
1.3.4氯仿敏感性检测
取1 mL(108PFU·mL-1)噬菌体液加入氯仿(1%体积),充分混合15 s后置于室温静置30 min,待分层后取上层溶液测定滴度。
1.4体外裂解作用
将奇异变形杆菌PM-XNR培养至对数生长期,PBS(pH=7.4)洗涤去除培养基,并调整细菌浓度为108PFU·mL-1,加入1 mL效价约为108PFU·mL-1的噬菌体XNR于37℃静置培养,分别于0、4、8、12、24 h测定培养液中细菌浓度以及噬菌体效价。
2结果与分析
2.1革兰氏染色和生物学特性检测
分离株在Baird-Parker琼脂培养基上菌落呈圆形褐色,边缘围绕一圈透明带,符合奇异变形杆菌在Baird-Parker琼脂培养基上生长特性,如图1 A所示。分离株经革兰氏染色后,显微镜下观察呈红色,无芽孢及荚膜,具有多形态性呈杆状、球状等(见图1 B);透射电镜能够清楚看到细菌形态,表面粗糙、有鞭毛(见图1 C);分离株在血琼脂培养呈灰白色菌落,具有溶血现象,散发特殊的腐败性臭味(见图1 D);分离株在尿素培养基中,培养18 h变为粉红色,说明分离株产生脲酶分解尿素(见图1 E),这也是泌尿系统产生结石的主要原因之一。通过上述革兰氏染色和生物学特性实验可以初步判定分离株为奇异变形杆菌。
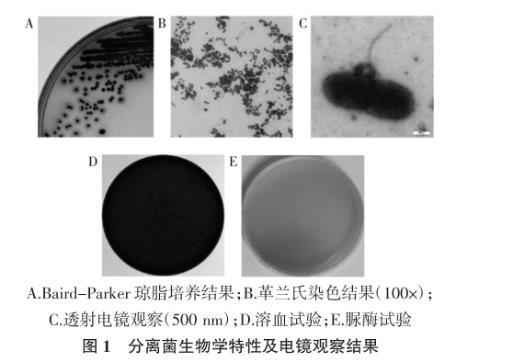
图1分离菌生物学特性及电镜观察结果
2.2 16Sr RNA序列同源性比较
细菌基因组经PCR扩增后,在1 500 bp左右出现单一条带(图2)。测序后BLAST分析比对,发现与其Query程度最高的几种16SrRNA序列均为奇异变形杆菌,其Query程度均高达98%以上,因此可以确定分离到的菌株为奇异变形杆菌,命名为PMXNR。
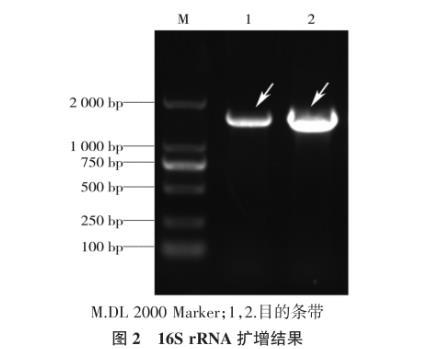
图2 16Sr RNA扩增结果
2.3药敏试验
18种药品对PM-XNR进行药敏试验,其中该菌株PM-XNR对头孢抗生素头孢吡肟敏感,对阿米卡星、氨苄西林、左氧氟沙星、氯霉素和环丙沙星中度敏感;对其他使用的抗生素均耐药。说明犬源奇异变形杆菌具有较强的耐药性。

表1 PM-XNR药敏试验结果(抑菌圈直径/mm)
相关新闻推荐
1、RW、WK、SF发酵菌株不同组合对紫秋葡萄酒品质、香气的影响(四)
