三种抗菌药物处理后持留菌株和抗药菌株生长曲线、优势的比较——结果与分析、讨论与结论
2结果与分析
2.1高药物浓度下获得持留菌株
在高药物浓度的培养条件(氨苄西林256μg/mL,环丙沙星1μg/mL,多粘菌素32μg/mL)下,持续作用6 d,依然能够检测到存活的细菌。按照接种量104 cfu/mL数量级计算,存活率在0.1%左右(表1)。此试验结果表明,即使在有限的空间内,只要初始接种量达到一定数量,高于致死浓度的抗菌药物并不能完全杀死细菌,总会有一小部分细菌存活下来。
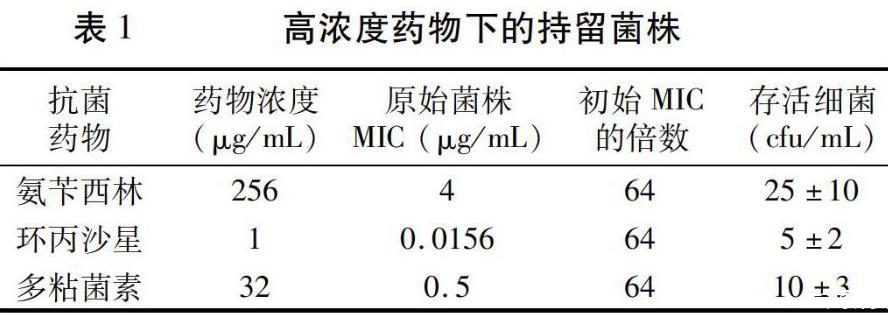
在药物氨苄西林浓度为256μg/mL条件下,先后共收集存活的细菌134株,测定其MIC,90%以上的菌株与原始菌株持平,少数略高于原始菌株一个或两个梯度,均远远低于其生存环境的药物浓度。环丙沙星和多粘菌素作用下的群体也存在同样的现象(数据略)。这些在高浓度药物作用下存活的细菌,其MIC却保持不变,为持留菌。致死量的抗菌药物不能将其杀灭,说明持留菌通过某种机制耐过了高浓度的药物,并且保持了原有的药物敏感特性。随机选取其中一株氨苄西林的持留菌,在氨苄西林浓度为256μg/mL的环境中得以存活,测定其分裂繁殖的后代实际MIC为4μg/mL,经传代后MIC保持不变,命名为菌株P-A,是原始菌株持留菌株繁殖后代的纯培养。
用同样的方法获得环丙沙星和多粘菌素作用下的持留菌株,分别耐过的药物浓度为1μg/mL和32μg/mL,保持原始菌株的MIC分别为0.0156μg/mL和0.5μg/mL不变。
2.2在递增的亚致死量药物浓度下传代获得抗药菌株
在药物选择压力不断提高的试验条件下获得一系列抗药性增强的菌株,能够在相应药物浓度下继续生长繁殖。这些菌株的MIC值远远高于原始菌株MIC。由于存在多种形成机制,在药物去除后有些抗药机制关闭,而有些抗药机制是稳定的,因此,在无药培养基中连续传代后,抗药菌株的MIC值有不同程度的回落,但都难以回复到原始菌株的敏感性。
经递增的亚致死量氨苄西林连续培养后,选取一株MIC稳定的耐过氨苄西林256μg/mL的抗药菌株,传代后MIC稳定在128μg/mL,是原始菌株MIC的32倍,命名为R-A。
用同样的方法获得环丙沙星和多粘菌素的抗药菌株,选取耐过1μg/mL环丙沙星和32μg/mL多粘菌素的抗药菌株,稳定的MIC分别为0.5μg/mL和8μg/mL。
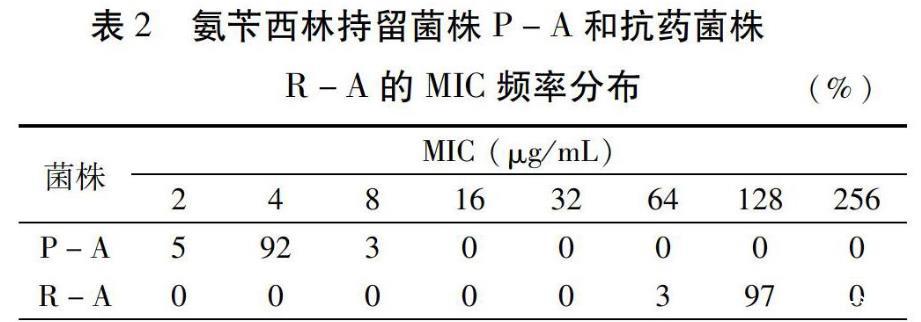
2.3持留菌株和抗药菌株的MIC范围
MIC值表示菌株对药物的敏感程度,是一个群体概念。由于细菌群体具有异质性,纯培养的细菌群体中小亚群的MIC也可能有所差异。因此,MIC并非一个准确的数值,而是一个范围。为了后续比较生长优势,先检测各类菌株的MIC范围,分别取100个单菌落测定MIC分布情况。氨苄西林药物处理的菌株MIC统计结果如表2,P-A的MIC分布峰值为4μg/mL,MIC与原始菌株持平;R-A的MIC分布峰值为128μg/mL,是原始菌株MIC的32倍。经过传代培养证明,两个菌株的MIC范围是稳定的表型指标,可以作为判定菌株性质的指标。对环丙沙星和多粘菌素处理菌株的稳定MIC范围也按同样的方法进行统计(数据略)。
2.4持留菌株和抗药菌株生长优势的比较
经检测,不同药物作用下筛选的两类菌株的生长曲线并无明显差异(生长曲线图略),因此可采取混合培养的方式,以各自MIC为衡量指标比较其生长优势。
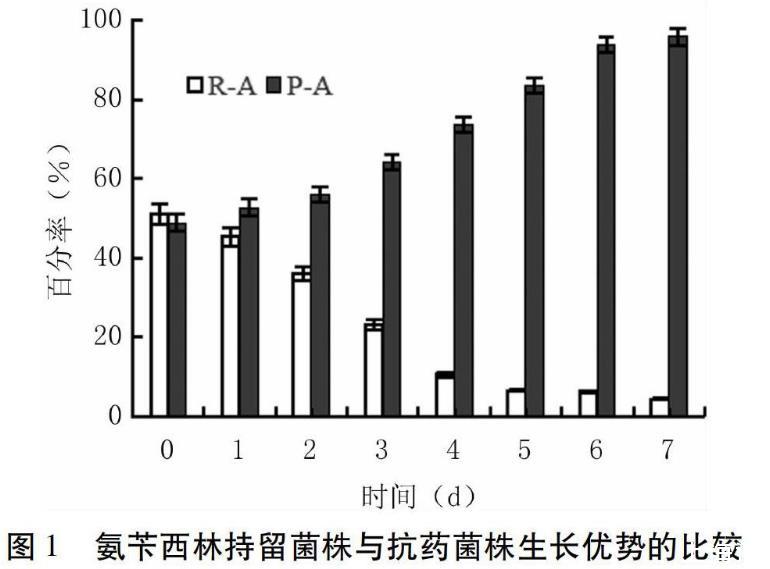
氨苄西林处理的P-A和R-A菌株MIC范围无相互交叉,将二者等比例混合接种培养,根据稳定的MIC范围统计其比例变化。如图1所示,混合培养后,持留菌株P-A所占比例逐渐升高,到第4 d增至70%以上,至第7 d抗药菌株R-A比例低于5%,菌株P-A数量占绝对优势。此结果表明,在没有药物的培养条件下,P-A具有更强的生长优势。随机挑选氨苄西林作用下存活的其它持留菌株和抗药菌株,用同样的方法对比其生长优势,也有类似的结果(数据略)。另外两种药物环丙沙星和多粘菌素的持留菌株和抗药菌株,生长优势的比较也存在类似结果(数据略),最终都能体现出持留菌株具有更强的生长优势。本研究中共检测8组菌株的对比,未检测到例外情况。
3讨论与结论
3.1细菌抗药性的意义
抗菌药物的广泛应用是筛选与富集抗药菌株的主要推动力,却并非抗药性产生的根源。抗药基因广泛而普遍地存在于环境中—病原菌、共生菌及多种环境微生物。越来越多的研究表明,抗药性是细菌的一个自然属性,彻底消除抗药性是不可能的。由于细菌遗传物质的自发突变、药物压力的筛选和诱导、复杂多样的抗药性机制、不可避免地与周围环境微生物接触等众多因素,即使在有限的空间内和特定條件下也难以完全消除细菌抗药性。从另一个方面看,抗药性对于细菌本身而言则意味着物种能够克服环境抗菌药物压力得以延续和存活,对环境微生物群落结构的多样性和稳定性起到了重要作用,对动物(包括人)免疫系统的形成、健康乃至整个生态环境都具有重大影响。
細菌的抗药性为菌株提供了额外的生物学特性,帮助提高微生物对特定环境的适应性,同时多数情况下会付出一定的抗性代偿,包括生长繁殖能力降低。因此,理论上原始菌株比抗药菌株具有更强的生长优势,但在抗菌药物压力下具有更强生长优势的原始敏感菌被杀死,而抗药菌株的敏感性回复则是复杂漫长的过程。
3.2持留菌的存在及在抗药性回复中的潜力
在林林总总的抗药表型和抗药机制中,持留菌以其独特的机制引起人们的注意。持留菌通过“休眠-恢复生长-增殖”的方式维持自身的生存和菌体结构稳定,巧妙躲过外界恶劣环境的影响而存留下来,但依然保持着原始菌株的特性。比较持留菌株与抗药菌株的生长优势,可引发对抗药性回复问题的重新思考。本文研究结果表明当去除抗菌药物压力后,抗菌药物压力下存活的持留菌株比抗药菌株具有更强的生长优势,这一结论尚未见其它类似文献。虽然持留菌的作用尚未经过全面验证,但面对生态中严峻的抗药性问题,持留菌的存在和特性还是提供了一线希望。在环境中抗菌药物压力不断增大的过程中,存留了一批批“沉睡”的“种子”——持留菌。当药物压力逐渐降低,人们对于抗药性水平降低的期待不仅停留在抗药菌株的敏感性恢复,也在于预留的持留菌“苏醒”并恢复活力,以更为原始的菌株特性与现存的抗药性细菌共同竞争,而多数抗药性细菌可能由于其抗性代偿而处于劣势。只有环境中菌群的抗药性水平整体回落才能根本解决抗药性问题,并非对抗药菌斩尽杀绝,也非阻断所有抗药性机制。本研究结论表明,持留菌的存在和形成机制保留了原始菌株的生长优势,随着抗菌药物使用水平的降低,可能在抗药性的逆转中起到一定作用。
相关新闻推荐
1、10种有机物对氧化亚铁硫杆菌BYM磁小体生长、合成、发酵、产量的影响(一)
