肠道微生物代谢物丁酸盐可维持肠道内稳态和调节肠道炎症
目前,微生物组的潜在作用是临床神经科学研究的前沿方向,其中大多数研究是有关胃肠道中数万亿的常驻微生物,即肠道微生物组。肠道微生物组与多种疾病有关,除了炎症性肠病、肠易激综合征、肥胖、神经退行性疾病等疾病之外,还与包括焦虑症、抑郁症等在内的精神健康障碍疾病息息相关。并且越来越多的证据表明,健康个体与焦虑抑郁患者之间的肠道微生物群组成之间存在差异。
肠道微生物组是一个多样化的生态系统,其中微生物互养关系和对营养的竞争影响着肠道微生物群落的稳定、组成和功能。迄今为止,多数研究只考虑了单个细菌分类群与临床表型之间的关系,而未考虑到肠道微生物菌群的动态和群落特性,而该特性可能是了解细菌-宿主通讯如何影响宿主生理的关键因素。
微生物组已涉及调节许多健康问题和条件。确定一种科学文献中没有涉及微生物组的疾病状态已经变得具有挑战性。然而,微生物组领域的因果关系主张往往被夸大,与它们所获得的实验证据不成比例。功能研究对于理解微生物组在各种条件和疾病中的作用至关重要。除了作为TLR配体调节各种免疫反应的肠道细菌产物外,细菌代谢物在维持肠道内稳态和调节肠道炎症方面也起着至关重要的作用。
在肠道细菌代谢物中,短链脂肪酸(SCFAs)是由膳食纤维发酵产生的肠道细菌代谢物,已被证明通过调节粘膜表面的各种免疫细胞来维持肠道内稳态。研究者和其他人已经证明,SCFAs促进肠上皮组织修复,增强肠道对肠道微生物群的IgA反应。
越来越多的证据表明,肠道微生物群抗原特异性CD4+T细胞在调节肠道炎症和维持肠道稳态中至关重要。Th1和Th17细胞分别通过产生促炎细胞因子IFNγ和IL-17介导肠道炎症,而Treg细胞通过产生TGF-β和IL-10抑制结肠炎。研究者最近证明,SCFAs调节肠道CD4+T细胞的发育,促进Th1细胞产生IL-10和IL-22,从而抑制肠道炎症。然而,SCFAs如何调节肠道CD4+T细胞的发育和功能仍不完全清楚。
颗粒酶B(GzmB)是CD8+T细胞和自然杀伤细胞杀死各种感染细胞和肿瘤细胞的功能标志,也被证明可以调节CD4+T细胞的功能,GzmB参与Treg细胞对T细胞的抑制。最近的一篇报道进一步证明,CD4+T细胞表达GzmB通过抑制Th17细胞的发育来抑制T细胞介导的结肠炎。然而,GzmB在肠道中如何调控T细胞表达尚不清楚。
近日,来自美国伊利诺斯州芝加哥西北大学范伯格医学院的研究者们在研究揭示了丁酸盐增加GzmB在产生il-10的耐受性Th1细胞中的表达,从而有助于维持肠道内稳态。
CD4+T细胞在调节自身免疫性疾病中发挥关键作用,肠道微生物代谢物控制各种免疫反应。颗粒酶B(GzmB)产生CD4+T细胞最近被报道参与自身免疫性疾病的发病机制。
在这里,研究者发现gzmbb缺陷的CD4+T细胞在Rag1−/−小鼠中诱导的结肠炎比野生型(WT)CD4+T细胞更严重。无菌(GF)小鼠在肠道CD4+T细胞中的GzmB表达低于无特异性病原体(SPF)小鼠。肠道微生物代谢物丁酸盐通过抑制HDAC和GPR43,而不是GPR41和GPR109a,增加CD4+T细胞中GzmB的表达,特别是在产生il-10的Th1细胞中。
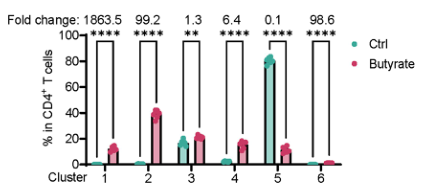
丁酸盐增加Th1细胞中GzmB的表达
在T细胞转移模型中,与丁酸盐处理的WT CD4+T细胞相比,丁酸盐处理的gzmb缺陷CD4+T细胞表现出更严重的结肠炎。丁酸盐改变了肠道菌群组成,但改变的菌群并未介导丁酸盐诱导小鼠肠道CD4+T细胞表达GzmB。Blimp1参与分泌il-10的Th1细胞中GzmB的丁酸盐诱导。葡萄糖代谢,包括糖酵解和丙酮酸氧化,介导丁酸盐诱导Th1细胞中的GzmB。此外,研究者发现IKZF3和NR2F6调节丁酸盐诱导的GzmB的表达。总之,该研究强调了GzmB在介导肠道细菌代谢物丁酸盐调节粘膜表面T细胞耐受性中的关键作用。
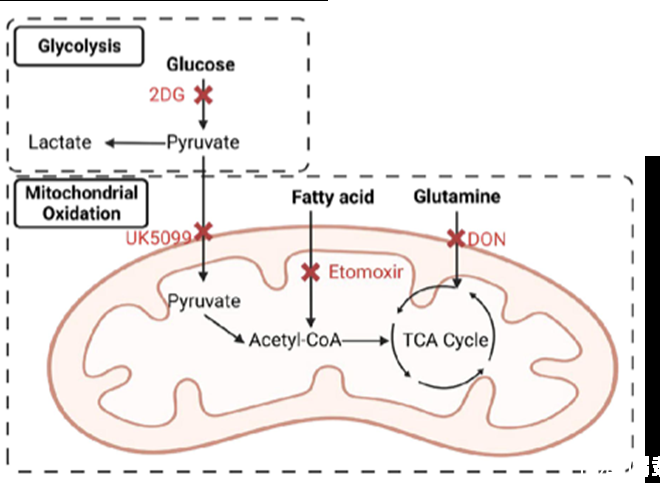
葡萄糖代谢介导丁酸盐诱导Th1细胞GzmB
综上所述,在本报告中,研究者证明了GzmB在无菌(GF)小鼠中产生CD4+T细胞减少,而丁酸SCFA通过抑制HDAC和GPR43而不是GPR41和GPR109a促进GzmB在CD4+T细胞,特别是产生IL-10的Th1细胞中的表达,这有助于丁酸抑制结肠炎的发展。丁酸盐增加GzmB在产生il-10的耐受性Th1细胞中的表达,从而有助于维持肠道内稳态。本报告扩展了人们对肠道菌群、Th1细胞反应和肠道疾病之间相互作用的认识。
相关新闻推荐
3、不同碳源、氮源、培养温度、PH值对褐藻酸降解菌AGN12菌生长及产酶的影响
