菌株双控制生长开关及其应用的遗传稳定性(一)
代谢工程和合成生物学为将细菌转化为生物工厂,从廉价的底物中生产有价值的化合物提供了广泛的可能性。用于生物生产的微生物工程相当于代谢通量从生长到产品合成的重新定位。这种细胞资源的重新分配面临着产量和生产力之间的基本权衡。产量的增加,即底物转化为产物的比例,会增加代谢负荷,从而降低生长速率。较低的生长速率导致较慢的生物量积累,并因此降低生产率,即降低感兴趣的化合物的总生产率。
处理这种权衡的一种广泛使用的方法是交替生长和生产阶段。沿着这些思路,研究人员在大肠杆菌中开发了一种合成生长开关,其中表达RNA聚合酶两个主要亚单位β和β′的操纵子受到异丙基-b-D-1-硫代半乳糖苷(IPTG)诱导型启动子的严格调控。研究发现,通过调节诱导剂的外部浓度,可以开启或关闭生长。此外,在生长停滞后,细菌能够从葡萄糖中产生甘油,产量接近理论最大值。
从进化的角度来看,许多合成回路都是脆弱的,因为携带该回路的宿主菌株被其必须运行的环境反向选择。这也适用于生长开关,即解除RNA聚合酶ββ’亚基编码基因抑制的自发突变会导致生长中的突变细菌迅速超过生长停滞的细菌群。生长开关的设计包括防止突变发生的保护措施,特别是编码阻遏物LacI的基因的冗余。然而,当在大规模生物反应器中进行高密度培养的长时间发酵过程时,有害的突变体发生的概率更高,并且这些保护措施可能是不够的。在大肠杆菌中,突变率约为每代每核苷酸2×10-10,这意味着在高细胞密度下,平均几次细胞分裂就足以使任何核苷酸突变。
通过建立进一步的冗余,可以控制RNA聚合酶表达的合成回路的遗传稳定性的进一步增加。在这里,研究人员开发了一种菌株,其中RNA聚合酶的另一个亚单位α被置于用于控制ββ’亚单位表达的同一lac系统的控制之下。因此,只有编码α(rpoA)和ββ′(rpoBC)的基因上游的两个启动子区域同时突变,才能使RNA聚合酶的表达控制失效,从而使生长控制失效。这显著增加了生长开关及其应用的遗传稳定性。
研究内容:
1.RNA聚合酶表达双调控大肠杆菌菌株的构建
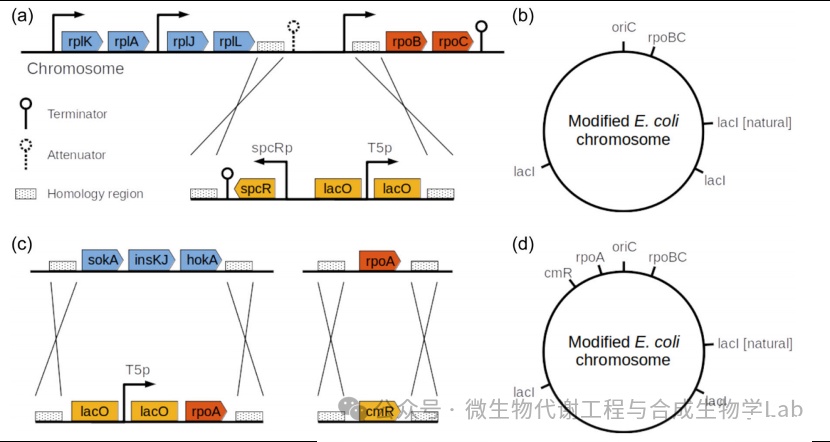
图1生长开关的交替设计:单控制(SC)和双控制(DC)
研究人员首先将编码β和β‘亚基的rpoBC基因置于一个可诱导启动子的控制下,来控制RNA聚合酶的表达。利用同源重组将天然启动子替换为T5启动子、两个lac操作子和大观霉素抗性。转录调控因子LacI与lac操纵序列结合,从而阻止RNA聚合酶转录rpoBC基因。当IPTG结合时,LacI与操纵符序列分离,从而缓解了基因的抑制。rpoBC基因也与核糖体基因rplKAJL一起被组织成一个操纵子。为了避免控制rplKAJL表达的启动子的通读转录,因此在大观霉素抗性基因的上游添加了一个强终止子(图1a)。
使用上述系统,可以通过IPTG外部控制RNA聚合酶的表达。当在培养基中添加IPTG时,会产生ββ‘-亚基,细菌正常生长。然而,在没有IPTG的情况下,rpoBC基因不被转录,也没有形成新的RNA聚合酶全酶。因此,细胞产生生物合成功能所需的RNA和蛋白质的能力下降,并最终停止生长。然而,这些细菌仍然具有代谢活性,可以利用它来引导营养物质从生长到产生一种感兴趣的化合物。
这种方法的一个缺点是,LacI基因的突变会阻止抑制因子与T5启动子区域结合,在生长停滞的条件下是非常有益的,因为有丰富的营养物质,但没有IPTG供应。携带这些突变的细菌能够在这些条件下生长,并将很快超过培养物。为了使生长开关对突变更稳定,因此在染色体上的不同位点上克隆了另外两个lacI拷贝(图1b)。这种冗余降低了由于lacI突变而失去生长控制的风险。这种策略导致了一个至少能稳定24小时的系统。
为了满足这一要求,研究人员进一步推进了冗余策略,将α-亚基基因置于第二个相同的T5启动子的控制下。α-亚基由rpoA基因编码,rpoA基因包含在核糖体基因rpsMKD和rplQ的操纵子中。与rpoBC基因相反,rpoA没有一个单独的启动子,并与核糖体基因共转录。为了避免核糖体基因的表达受到干扰,研究人员将rpoA克隆到sokA-insKJ-hokA序列中,用氯霉素抗性取代了rpoA的自然拷贝(图1c,d)。
2.RNA聚合酶表达的双重控制导致了一个功能性的生长开关
SC菌株表现出一种开关样的诱导模式:对于低浓度的IPTG,菌株不生长,而高于阈值浓度,菌株的生长速度与WT菌株大致相同。为验证在DC菌株中实现的ββ'‐和α‐亚基诱导控制的改进设计是否保留了这种开关表型。研究人员将SC和DC菌株在M9最小培养基中预培养,添加0.2%葡萄糖和250µM IPTG,以保证RNA聚合酶的表达和生长。将预培养物洗涤并重新稀释到相同的培养基中,但添加了不同浓度IPTG,范围为0至500µM。
在SC应变的曲线中,0-20µM的IPTG中,由于预培养中RNA聚合酶的积累,有一些残留的生长,当RNA聚合酶被稀释后停止。然而,吸光度仍然可以忽略不计。相反,当浓度为40µM或更高时,rpoBC的诱导足以使菌株生长,其速度与WT菌株相似。为了量化这一观察结果,研究人员确定了生长培养物在指数中期的生长速率,并将生长受阻的菌株的生长速率设置为0(图2c)。该图清楚地显示出了SC应变在IPTG阈值浓度附近的开关行为。
DC菌株也表现出一个开关表型,具有近似相同的开关阈值,尽管在40µM时,尚未达到最大的生长速率(图2b)。此外,其最大生长速率低于WT菌株。DC的生长产量,即限制碳源(0.2%葡萄糖)产生的最大生物量,也低于WT菌株,这与SC菌株的观察结果相反(图2a,b)
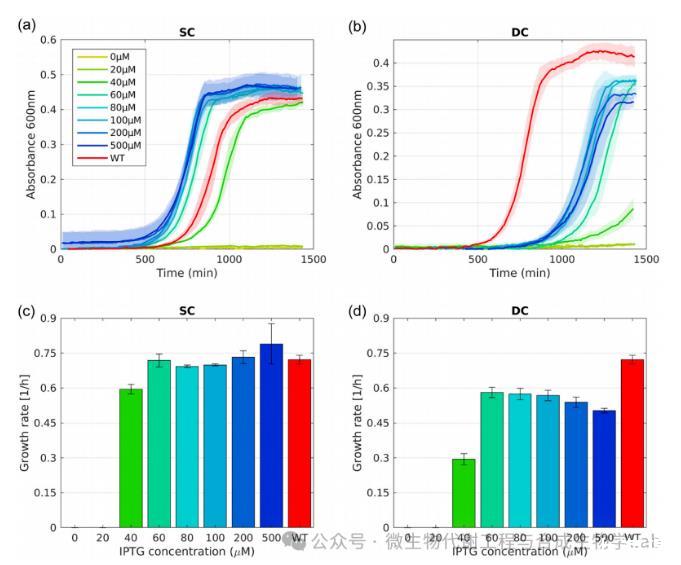
图2单调控(SC)和双调控(DC)菌株的生长开关行为
这两种菌株的不同设计可以解释SC菌株和DC菌株转换表型的差异。对于高IPTG水平,SC中β‘-亚基的浓度高于WT菌株。因为rpoB和rpoC以大约相同的速率共转录和翻译,这可能也适用于β-亚基。因此,在SC菌株中,功能核心RNA聚合酶的浓度将受到高IPTG水平下(自然表达的)α-亚基的浓度的限制。然而,在DC菌株中,rpoA也是从T5启动子转录出来的(并且与rpoB具有相同的核糖体结合位点)。考虑到ω-亚基是非必需的,因此,对于高水平的IPTG,DC中功能核心RNA聚合酶的浓度高于SC中。这可能导致不必要的更高的转录活性,导致适应度成本,从而导致生长缺陷。
相关新闻推荐
1、干旱对青藏高原高寒草原微生物共现网络和土壤功能的影响(一)
3、亚胺培南&盐酸小檗碱可提高对耐碳青霉烯类铜绿假单胞菌抑制作用——结果、讨论
