茶树根际细菌菌株P5菌株对花生种子的促生机制
植物根际促生菌(plant growth-promoting rizobacteria,PGPR)是指以定殖或自由附着的方式生活在植物根际的一类细菌总称[1]。它能改变根际土壤的理化性质、提高根际土壤中对植物生长有利的营养元素的转化[2],也可通过分泌铁载体、有机酸、生物表面活性剂、植物生长激素等,直接或间接促进植物的生长[3]。不同植物根际分离到的促生菌菌株对相应植物的种子萌发可能具有一定的促进作用。从柳枝稷根茎中分离筛选到可分泌IAA的Pseudomonas和Rhizobium细菌菌株,接种后可以提高盐胁迫下柳枝稷种子的发芽率,促进胚根和胚芽的生长[4]。从西藏黑青稞根际筛选到的4株菌株对青稞种子发芽促进作用显著,但不同菌株影响有差异[5]。而从大豆种子中分离到的内生芽孢杆菌菌株,大部分均表现出促进大豆发芽的作用,其中促生作用最好的SN 10 E 1菌株为巨大芽孢杆菌[6]。也有报道表明促生作用并不仅仅局限在同种属的植物中。
李青梅等发现,经胶质芽孢杆菌菌剂处理的黄瓜、番茄、茄子及辣椒等4种蔬菜种子的发芽率均高于对照,但对蔬菜幼苗根生长的影响因蔬菜种类不同而异[7]。而从油菜根际土壤中分离到的3株菌N-1、N-15、K-25可使桔梗种子的发芽率和幼苗茎长明显高于对照,也证明从一种植物根际能分离到对另一种植物有促生作用的功能菌,促生菌在不同植物根际的分布和作用存在交叉现象[8]。
在前期研究中,本实验室从茶树根际分离筛选到4株细菌菌株,其中PseudomonashunanensisGD 3具有溶磷解钾能力,AgrobacteriumradiobacterKKS-6-N 1菌株具有固氮能力,2个菌株对白菜、空心菜及苋菜具有促生作用[9-10]。P 5菌株是采集茶树根际土壤、以阿须贝无氮培养基筛选获得的1株细菌,具有一定的固氮效能,而其余的促生特性还未知。本研究拟通过P 5菌株与2株具优良促生性能的GD 3和KKS-6-N 1进行浸种试验,比较不同菌株对辣椒和花生种子萌发的影响;并通过灌根处理盆栽花生幼苗,研究P 5菌株对花生根际土壤微生物功能的影响效应,从根本上解析P 5菌株的促生机制。
1材料
1.1供试菌株及材料
3株茶树根际细菌菌株GD 3、KKS-6-N 1和P 5(未知种属)均为本实验室从不同环境茶树根际土壤中分离获得,保存于本实验室。
1.2供试材料与土壤
供试花生及辣椒种子均为当地市售种子。土壤来源于贵州省贵阳市花溪区贵州大学南校区农田土壤(26°42′48″N,106°67′31″E),去除表面枯枝浮土后,采集距表面20~50 cm处土壤,过筛后用于盆栽试验。
1.3培养基
LB培养基、高氏一号培养基及马丁培养基按《微生物学实验教程》[11],参考Mab等[12]的方法配制蛋白胨氨化培养基、吴翔等[13]的方法配制阿须贝氏无氮培养基,NBRIP培养基参考Nautiyal等[14]的方法,亚历山大硅酸盐培养基参考何琳燕等[15]的方法。
2方法
2.1菌种的活化及菌液的制备
将保存于-80℃超低温冰箱中的GD 3、KKS-6-N 1和P 5菌液取出适量,接种于LB培养基中,于30℃恒温摇床中,150 r·min-1振荡培养过夜活化;翌日取活化的菌液再次转接于LB培养基中,相同条件下培养24 h,菌液测定OD600值,以无菌LB调整该值为1.0备用。
2.2菌株浸种处理对辣椒种子萌发及盆栽试验的影响
将辣椒种子置于3%次氯酸钠溶液中进行表面消毒10 min,用蒸馏水反复清洗多次后,处理组的辣椒种子分别置于OD600值为1.0的3种菌液中浸种2 h,未处理组对照种子则置于LB培养基中;浸种完成后用无菌滤纸略微蘸干表面液体、置于铺有被无菌水润湿的无菌滤纸的培养皿中,于30℃恒温培养箱中放置15 d,期间保持滤纸湿润,统计辣椒种子的发芽率;之后移栽于装有300 g土壤的育苗盆中进行盆栽试验,整个试验期间保持土壤湿润,30 d后收获测定植株生长指标。试验设对照组、GD 3处理组、KKS-6-N 1处理组和P 5处理组,每组为25粒种子,重复3次;盆栽试验时每组6株幼苗,重复3次。
2.3菌株浸种处理对花生种子萌发的影响
将花生种子置于20%过氧化氢溶液中进行表面消毒20 min,经蒸馏水反复清洗后浸泡6~12 h,以无菌滤纸略微蘸干后置于3种菌株的菌液中进行2 h浸种处理,对照种子则置于LB培养基中;待浸种完成后,置于铺有滤纸的培养皿中,30℃恒温培养箱中放置3 d,统计花生种子的发芽率。种子试验设计及处理同上。
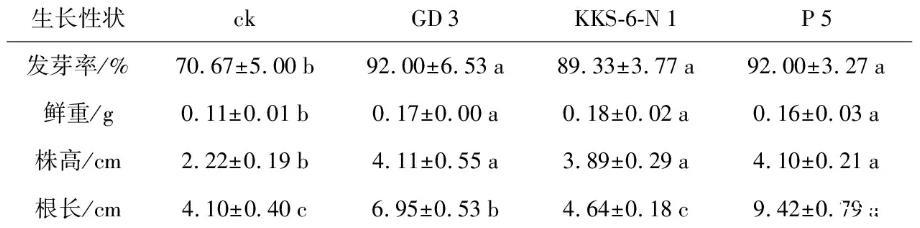
表1 3株茶树根际细菌浸种对辣椒种子萌发及幼苗生长的影响
注:同一行不同小写字母代表不同处理之间差异显著(p<0.05)。下同。
2.4菌株灌根处理对花生幼苗生长的影响
将花生种子经过氧化氢消毒,蒸馏水清洗浸泡后,置于铺有无菌滤纸的培养皿中,30℃条件下3 d待种子萌发后,选择长势相当的花生幼苗移栽于育苗盆中,以未接种菌株为对照,设置GD 3接种组、KKS-6-N 1接种组和P 5接种组,每2 d采用灌根法接种菌液,接种量为每次5 mL,对照组则用等量无菌LB培养基代替,每组均设6个重复,常规方式管理。30 d后测定花生株高、鲜重、根重及叶绿素含量等生长及生理指标,叶绿素含量采用Arnon法测定。
2.5 P 5菌株灌根对花生营养指标的影响
盆栽实验30 d后,测定P 5接种组及对照组花生植株的营养指标,植株全氮含量测定采用凯氏定氮法,全磷含量测定采用钼锑抗比色法,全钾含量测定采用火焰分光光度法[16]进行。
2.6 P 5菌株灌根对花生根际土壤三大菌群及功能菌群的影响
30 d盆栽实验后,利用抖根法收集P 5处理组的花生根际土壤,测定土壤三大菌群(细菌总数、放线菌总数及真菌总数),功能菌群数量的测定包括氨化细菌、固氮菌、溶磷菌及解钾菌等4种类型。细菌、放线菌及真菌总数分别以LB固体培养基、高氏一号培养基及马丁培养基测定,采用稀释平板涂布法进行计数;以蛋白胨氨化培养基培养氨化细菌,采用最大近似值法(MPN,most probable numbers)测定;固氮菌、溶磷菌及解钾菌分别以阿须贝无氮培养基、NBRIP培养基及亚历山大硅酸盐培养基培养,以稀释涂布平板法计数。
2.7 P 5菌株灌根对花生根际土壤酶活性的影响
采集P 5灌根处理30 d的花生根际土壤进行土壤酶活性测定。土壤蔗糖酶酶活的测定采用硫代硫酸钠滴定法,单位酶活是指每克干土所消耗的硫代硫酸钠(0.05 mol·L-1)体积(mL·g-1)[17];过氧化氢酶酶活采用高锰酸钾滴定法,单位酶活是指每克干土于20 min内所消耗的高锰酸钾(0.1 mol·L-1)体积(mL·g-1);脲酶酶活的测定采用苯酚钠-次氯酸钠比色法,单位酶活是指37℃条件下、24 h处理后每克风干土壤中的氨氮含量(mg·g-1)[18];中性磷酸酶酶活是指每克干土经24 h处理后释放酚的体积(mg·g-1),参照吴金水等[19]的方法进行测定。
2.8 P 5菌株的分子生物学鉴定及系统发育树构建
P 5菌株的初步鉴定采用分子生物学方法进行。利用细菌DNA提取试剂盒抽提菌株的DNA,以细菌16 S rRNA基因的通用引物对27 F/1492 R进行PCR扩增,上、下游引物序列分别为27 F(5′-AGAGTTTGATCMTGGCTCAG-3′),1492 R(5′-TACGGYTACCTTGTTACGACTT-3′)[20]。PCR扩增体系及扩增条件参考王欢等[10]的方法。扩增产物经琼脂糖凝胶电泳,检测到有既定大小的条带(约1 500 bp)送至上海英骏生物工程公司测序。获得的核苷酸序列经NCBI网站上BLAST进行在线同源性比较,选择相似性最高的结果进行分析。选取克雷伯氏菌属的不同种菌株用于系统发育树的构建,以PseudomonasmooreiRW 10 T(AM 293566)作外群。采用Clustal W 2进行多重序列比对、Mega 6.0构建系统发育树,进行1 000次自展检验[21]。
2.9数据分析与处理
采用SPSS 20.0软件,以LSR多重比较对数据进行分析。
相关新闻推荐
1、不同条件下裂片石莼水培液的组成成分对耐药弧菌株的抑菌作用(三)
2、传统腌干鱼制品中降解生物胺菌株的筛选、生长曲线及影响因素(三)
