单一外源微生物的生长繁殖情况研究——诱变菌B38的生长曲线绘制
为实现对土壤修复过程中所加入的单一外源微生物的生长繁殖情况进行跟踪监测的目的,本论文创新性的引入荧光示踪技术。使用荧光染料DAPI对诱变菌的DNA 进行标记,与微生物载体诺沃肥复合后,接种于受污染土壤。通过筛选DAPI 染料的使用浓度与菌悬液的稀释比例,采用荧光计数技术,成功的实现对外源微生物在土壤中的生长繁殖情况的跟踪研究。为外源微生物生长繁殖的定量化研究提供了一种简便、快捷的方法,保证生物强化修复技术的顺利实施。
培养基及溶液的配制
使用液体牛肉膏~蛋白胨培养基对活性菌株B38进行培养。培养基的配制方法为:准确称取蛋白胨 10g/L,氯化钠 5g/L,牛肉膏5g/L,用 1mol/L的盐酸和 1mol/L的氢氧化钠调节 pH=7.2,于121℃高压蒸汽灭菌30min备用。
0.85 %(M/V)生理盐水的配制:准确称取0.85g氯化钠,溶解后用蒸馏水稀释至 100mL,于121℃下高压灭菌30min备用。
DAPI 储备液的配制:用双蒸水将 DAPI 粉末配制成 1.0×103μg/mL的储备液,于~20℃保存备用。
DAPI工作液的配制:用磷酸盐缓冲溶液(PBS,pH=7.4)分别稀释储备液至 10μg/mL、0.1μg/mL,制得DAPI工作液,于4℃保存备用。
菌种的培养及生长曲线的测定
本实验中用到的诱变菌种 B38为实验室前期以枯草芽孢杆菌为初始菌种,通过紫外诱变5min得到的高效镉耐受性的诱变菌种。出发菌枯草芽孢杆菌购买自国家普通微生物菌种保藏管理中心(CCGMC)。出发菌株对镉有一定的抗性,其最小抑制浓度(MIC)为 0.25mmol/L,而选育出的 B38菌种,其抗镉性能大大提高,MIC达到了3mmol/L.
将B38菌体接种于5mL牛肉膏蛋白胨液体培养基中,于37℃,150r/min活化培养10h至对数生长期中段;之后取 1mL菌悬液接种于 100mL牛肉膏蛋白胨液体培养基,于37℃,150r/min扩大培养。每隔 2h,利用紫外可见分光光度计测定菌悬液的OD600值,并同时对菌悬液进行显微计数,测定B38的生长曲线。每组实验设置3个平行。
结果
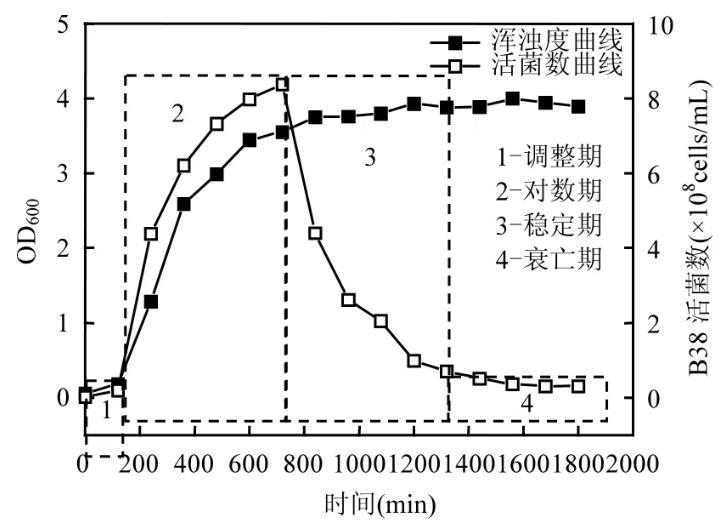
图1 B38菌种的生长曲线
诱变菌B38的生长曲线如图1所示。B38的生长繁殖分为4个阶段:调整期(1)、对数期(2)、稳定期(3)和衰亡期(4)。B38在 2h左右进入对数生长期,此阶段菌体快速生长,生物量迅速增加;12h后,菌体进入稳定期,活菌数曲线和浑浊度曲线同时达到峰值。处于对数生长期中后段的菌株具有较高的生理活性,因此,选择培养时间为10h,即培养至对数生长期中后段的菌悬液进行后续实验。
将12h以内的活菌数与菌悬液的OD600值进行线性回归,拟合结果见图 2.从接种期至对数生长期结束,活菌数与菌悬液的 OD600值之间存在显著正相关关系(r2=0.9766),因而在后续培养实验中,采用测定对数生长期B38菌悬液OD600值的方法,通过线性回归计算对细菌数量进行计数,这一发现可显著提高实验效率。
结论
为研究土壤中施加外源微生物B38后,其菌体浓度随时间的变化情况,本文创新性的引入了DAPI荧光染色技术标记微生物的DNA分子进行显微荧光示踪计数研究。选择不同浓度梯度的染料进行对比,结果显示使用高浓度的工作液镜检下荧光反应过强,无法识别单个菌体,最终选择0.1μg/mL的DAPI为最适浓度。
为能够对菌体数进行准确计数,选择不同稀释倍数进行镜检。结果发现当菌悬液稀释 106倍后,菌体分散度高、数量适中,可实现计数。使用荧光显微计数得到的 B38 菌体浓度为(3.21± 0.22)×108cells/mL,使用OD600值换算得到的浓度为(4.92±0.15)×108cells/mL,二者达到高度一致,因此荧光染色显微计数方法准确可行。
将标记后的B38加入土壤中,传代培养10h后,提取土壤微生物悬液对B38菌体进行荧光计数,所得菌体浓度为(5.58±0.13)×108cells/mL,符合B38的生长曲线。因此经过标记的外源微生物的荧光特性在传代过程中得到了良好的保持。
在60d的时间内跟踪外源微生物B38在实际土壤修复过程中的数量变化。结果发现B38对恶劣的环境有较高的适应性和发展潜力;在添加了微生物载体后,由于载体物质为土著微生物和外源微生物同时提供碳源、氮源及其他营养物质,此时,土著微生物对B38的生长繁殖起到了部分竞争抑制作用,但是 B38菌体浓度仍达到(1.05±0.01)×1010cells/mL,与初期施加量相比,提高了近3个数量级,外源微生物得到了良好的生长繁殖。
相关新闻推荐
2、维氏气单胞菌分离与纯化、一步生长曲线、热稳定性及pH稳定性研究(一)
3、基于生长速率法评估植物乳杆菌Bx6-2的发酵液对甜瓜疫霉菌抑制效果(二)
