检测多株益生菌和多株致病菌,综合比较各益生元的益生活性
益生元的种类很多,如低聚半乳糖,低聚果糖,菊粉,低聚木糖,2’-岩藻糖基乳糖等。目前使用一种代表性的益生菌和一种代表性的肠道菌,以同时促进有益菌和致病菌的葡萄糖作为阳性对照,按照如下公式进行检测计算:和代表培养24h和0h时有益菌在益生元上培养的活菌落形成单位(CFU)/mL,和代表培养24h和0h时有益菌在葡萄糖上培养的活菌落形成单位(CFU)/mL,和代表培养24h和0h时肠道菌在益生元上培养的活菌落形成单位(CFU)/mL,和代表培养24h和0h时肠道菌在葡萄糖上培养的活菌落形成单位(CFU)/mL。评分的设计要求益生元促进有益菌生长,而不支持致病菌生长,以体现益生元定义中的“选择性”。
但仅以单一菌株评分主观性太强。肠道有益菌(双歧杆菌,乳杆菌,芽孢杆菌等)和致病菌(坂崎肠杆菌,空肠弯曲杆菌,克雷伯氏菌等)种类众多,因此益生元检测计算结果完全取决于选定的菌株。而且,公式从表象反映益生菌的数目,不能直观反映益生元是否被益生菌所利用。另外,活菌落形成单位的实验周期长,实验精度要求高,容易产生误差。因此,通过检测多株益生菌和多株致病菌来反映益生元活性是更有效准确的方式,能够综合且横向比较各益生元的益生活性。
一种基于多菌株的益生活性检测步骤:
步骤一,选取用于益生活性待检测的菌株,菌株包括有益菌和致病菌,菌株数目大于3;
步骤二,以待评益生元作为培养基唯一碳源对选取的菌株进行培养,葡萄糖碳源培养基作为阳性对照组,无糖培养基作为空白组;
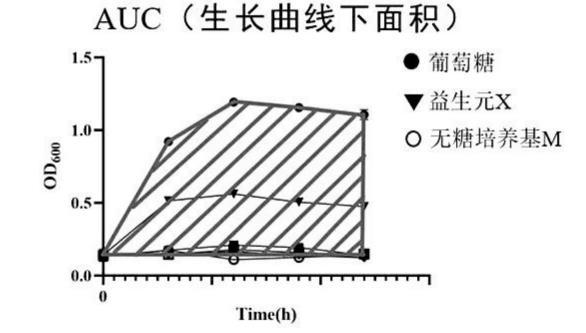
步骤三,获取步骤二中所有菌株的生长值,以培养过程中各时间点的OD600吸光值绘制生长曲线,计算生长曲线下面积,进而计算各菌株的生长值;
步骤四,获取菌株对益生元的利用值,对每个菌株的培养前和培养后菌液上清进行薄层层析图谱分析,计算薄层层析图谱中益生元的消耗量,进一步计算各菌株的益生元利用值;
步骤五,通过步骤三中的生长值和步骤四中的益生元利用值计算益生活性。
菌株纯培养
选取4种益生元:半乳低聚糖,岩藻寡糖,2’-岩藻糖基乳糖和岩藻糖,葡萄糖作为阳性对照组,无糖培养基为空白组。选取4株益生菌:1株双歧杆菌,1株乳杆菌,1株丁酸梭菌,1株粪肠球菌。4株潜在致病菌:1株大肠杆菌,1株沙门氏菌,1株克雷伯氏菌,1株产气荚膜梭菌。用酶标仪从初始0h开始每12h测定菌液OD600值,上清液用于薄层层析。
基于OD600值的生长曲线下面积(AUC)计算。
生长值测定:以0h、12h、24h、36h、48h的OD600值绘制生长曲线,并通过积分计算曲线下面积(AUC;OD600×min)。益生元X的AUC值减空白组M的AUC值为菌株的生长值,公式如下:
由各菌株的生长曲线和生长值可知,同一益生元,不同菌株的生长情况不同。葡萄糖对有益菌株和潜在致病菌均有较好的促生长能力,而低聚半乳糖除了显著促进有益菌生长,也部分促进潜在致病菌生长。岩藻寡糖能够促进3株有益菌生长,基本不支持潜在致病菌生长。2’-岩藻糖基乳糖仅被1株有益菌利用,但严格不支持潜在致病菌的生长。岩藻糖不能促进大部分菌株增殖,甚至对粪肠球菌和大肠杆菌的生长具有部分抑制作用。
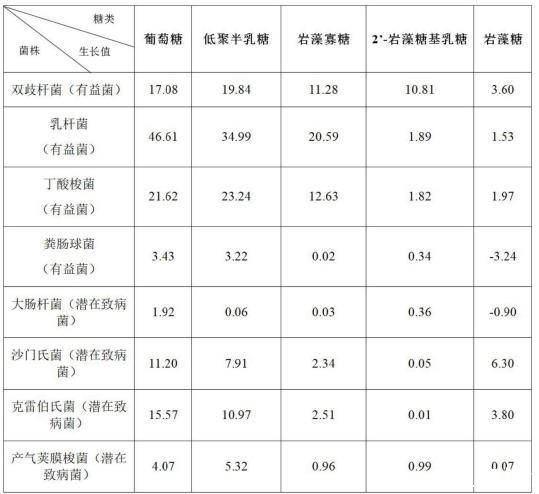
表1各菌株的生长值
相关新闻推荐
2、利用细菌生长曲线表征芳樟醇对三文鱼莓实假单胞菌MS 02的抑菌效果(二)
