10种有机物对氧化亚铁硫杆菌BYM磁小体生长、合成、发酵、产量的影响(二)
2、结果与分析
2.1不同有机物对Acidithiobacillus ferrooxidans BYM生长的影响
本研究通过改变培养基中添加有机物的浓度,探究不同有机物的不同浓度对A.ferrooxidans BYM生长的影响。
2.1.1亚铁氧化速率的比较
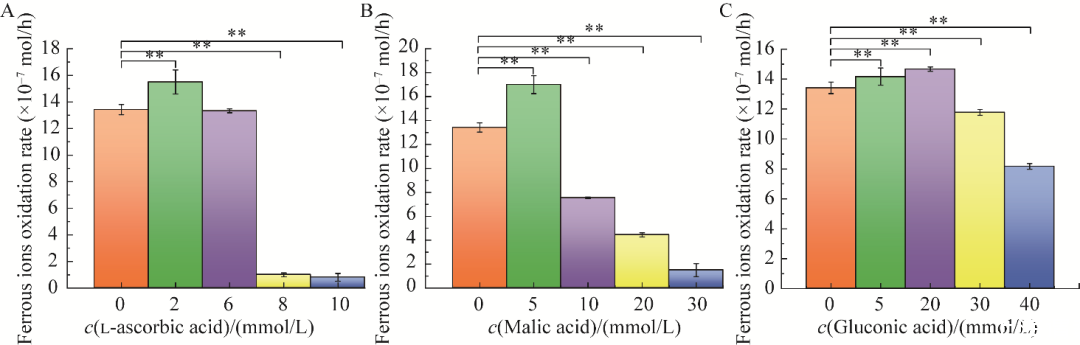
图1不同浓度不同小分子有机酸对Acidithiobacillus ferrooxidans BYM亚铁氧化速率影响A:l-抗坏血酸.B:苹果酸.C:葡萄糖酸.**表示P<0.01
在探究不同有机物的不同浓度对A.ferrooxidans BYM生长的影响试验中,l-抗坏血酸、苹果酸以及葡萄糖酸的添加可促进A.ferrooxidans BYM的亚铁氧化。如图1所示,随着l-抗坏血酸(图1A)和苹果酸(图1B)浓度的增加,A.ferrooxidans BYM亚铁氧化速率总体呈现逐渐降低的趋势,2 mmol/L l-抗坏血酸添加组与5 mmol/L苹果酸添加组的亚铁氧化速率显著高于未添加有机物组,表明2 mmol/L l-抗坏血酸与5 mmol/L苹果酸对A.ferrooxidans BYM亚铁氧化速率具有促进作用。随着葡萄糖酸(图1C)浓度的增加,其亚铁氧化速率呈现先上升后下降的趋势。5 mmol/L和20 mmol/L葡萄糖酸添加组的亚铁氧化速率均显著高于未添加有机物组,表明5 mmol/L和20 mmol/L葡萄糖酸对A.ferrooxidans BYM亚铁氧化速率具有促进作用。其中,2、8、10 mmol/L的l-抗坏血酸添加组相较于未添加有机物组存在极显著差异(P<0.01),5、10、20、30 mmol/L的苹果酸添加组相较于未添加有机物组存在极显著差异(P<0.01),5、20、30、40 mmol/L的葡萄糖酸添加组相较于未添加有机物组存在极显著差异(P<0.01)。
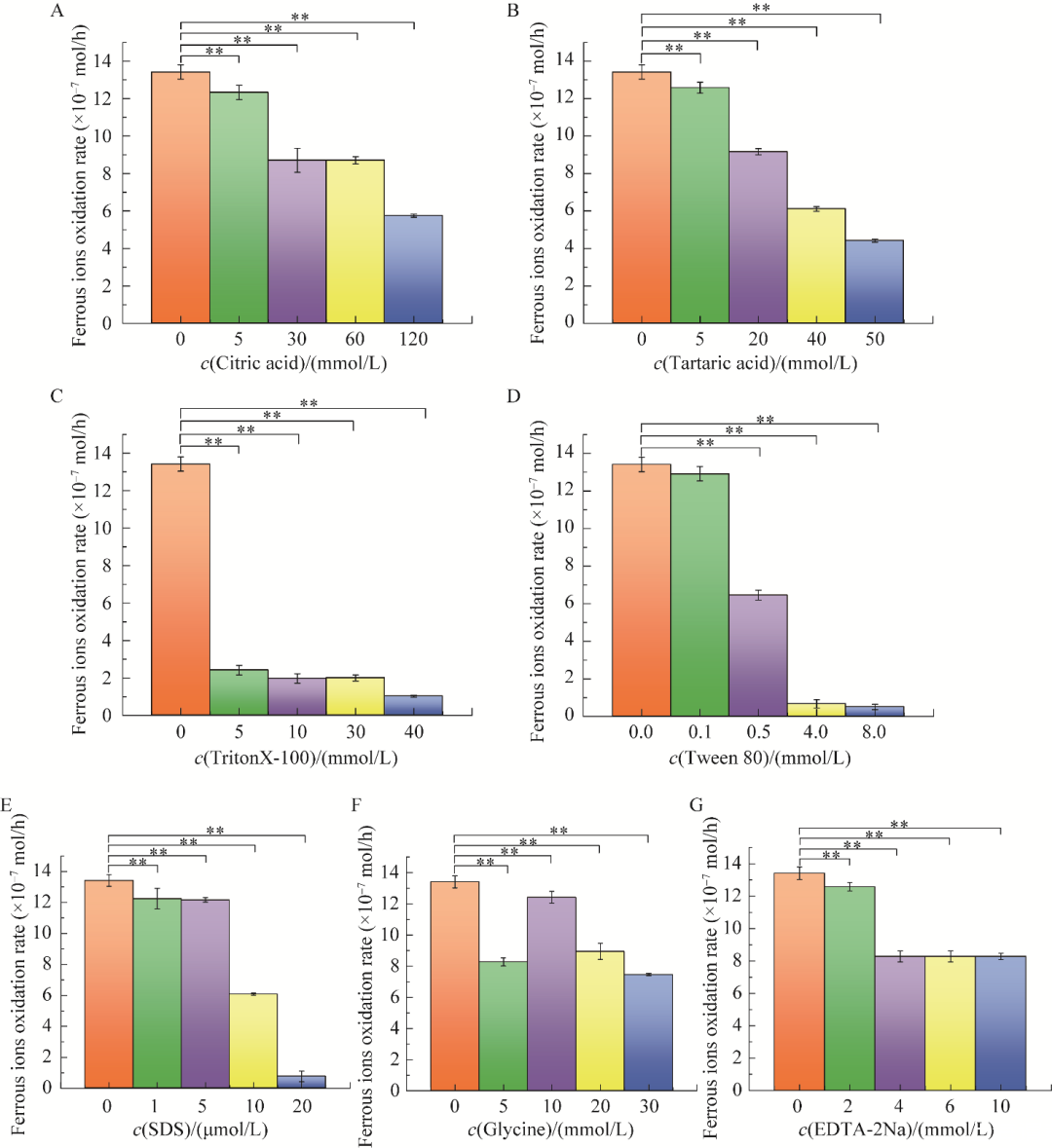
图2不同浓度不同有机物对Acidithiobacillus ferrooxidans BYM亚铁氧化速率影响A:柠檬酸.B:酒石酸.C:TritonX-100.D:吐温-80.E:SDS.F:甘氨酸.G:EDTA-2Na.**表示P<0.01
如图2所示,添加不同浓度柠檬酸、酒石酸、TritonX-100、吐温-80和SDS,随着有机物浓度的增加,A.ferrooxidans BYM亚铁氧化速率均整体呈现下降趋势。柠檬酸添加组(图2A)、酒石酸添加组(图2B)、TritonX-100添加组(图2C)和SDS添加组(图2E)相较于未添加有机物组均存在极显著差异(P<0.01)。0.5、4、8 mmol/L吐温-80添加组(图2D)相较于未添加有机物组均存在极显著差异(P<0.01)。说明柠檬酸、酒石酸、TritonX-100、吐温-80和SDS的存在均会影响A.ferrooxidans BYM亚铁氧化速率,抑制菌体的生长。
如图2所示,根据甘氨酸和EDTA-2Na试验可知,随着甘氨酸浓度的增加,其亚铁氧化速率呈现先上升后下降的趋势(图2F)。增加EDTA-2Na浓度,其亚铁氧化速率呈现先降低然后趋于平稳的趋势(图2G)。甘氨酸添加组与EDTA-2Na添加组相较于未添加有机物组均存在极显著差异(P<0.01)。由此可说明,上述有机物的添加均会抑制A.ferrooxidans BYM的亚铁氧化能力。
综上所述,l-抗坏血酸浓度为2 mmol/L、苹果酸浓度为5 mmol/L、葡萄糖酸为5 mmol/L和20 mmol/L时均会促进A.ferrooxidans BYM的亚铁氧化速率,分别可达到1.55×10−6、1.70×10−6、1.42×10−6和1.47×10−6 mol/h。然而,其他有机物的添加均对A.ferrooxidans BYM亚铁氧化产生抑制作用。因此,选择l-抗坏血酸、苹果酸和葡萄糖酸进行下一步试验。
为进一步筛选磁小体合成最优促进剂,选用l-抗坏血酸(0、0.5、1.0、1.5、2.0 mmol/L)、苹果酸(0、0.5、1.0、3.0、5.0 mmol/L)和葡萄糖酸(0、5、10、15、20 mmol/L)进行试验,以A.ferrooxidans BYM达到对数期的亚铁氧化速率、菌体湿重和磁小体产量作为筛选标准(图3)。
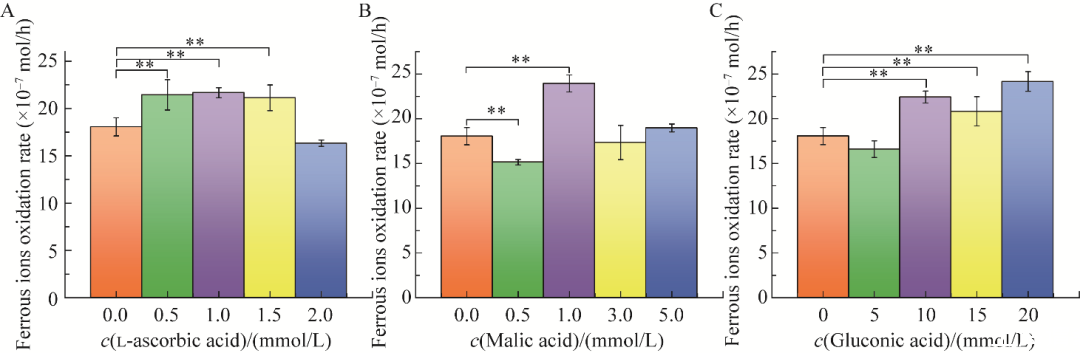
图3不同有机酸对Acidithiobacillus ferrooxidans BYM亚铁氧化速率影响A:l-抗坏血酸.B:苹果酸.C:葡萄糖酸.**表示P<0.01
如图3所示,1.0 mmol/L l-抗坏血酸对A.ferrooxidans BYM菌体生长的促进作用最显著(图3A),其亚铁氧化速率可达2.17×10−6 mol/h。1.0 mmol/L的苹果酸对A.ferrooxidans BYM菌体生长的促进作用最明显,其亚铁氧化速率高于l-抗坏血酸,可达2.40×10−6 mol/h(图3B)。葡萄糖酸浓度为20 mmol/L时,对A.ferrooxidans BYM菌体生长的促进作用最明显,其亚铁氧化速率最高,可达2.42×10−6 mol/h(图3C)。0.5、1.0、1.5 mmol/L l-抗坏血酸添加组相较于未添加有机物组均存在极显著差异(P<0.01),0.5 mmol/L和1.0 mmol/L苹果酸添加组相较于未添加有机物组均存在极显著差异(P<0.01),10、15、20 mmol/L葡萄糖酸添加组相较于未添加有机物组均存在极显著差异(P<0.01)。
2.1.2菌体生长的比较
如图4所示,l-抗坏血酸以1.5 mmol/L添加时,其菌体浓度高于未添加组,可达0.160 g/L(图4A),相较于未添加组存在极显著差异(P<0.01)。
其中,0.5 mmol/L l-抗坏血酸试验组菌体湿重较低,相较于未添加组存在极显著差异(P<0.01)。苹果酸浓度在1 mmol/L时,其菌体浓度略高于未添加有机物组,此时菌体浓度最高,可达0.145 g/L(图4B)。其中,3 mmol/L和5 mmol/L苹果酸试验组相较于未添加有机物组存在极显著差异(P<0.01)。当葡萄糖酸添加量为15 mmol/L,其菌体浓度最高,可达0.188 g/L(图4C)。其中,添加10 mmol/L葡萄糖酸试验组相较于未添加有机物组存在显著差异(P<0.05),添加15 mmol/L和20 mmol/L葡萄糖酸试验组相较于未添加有机物组存在极显著差异(P<0.01)。
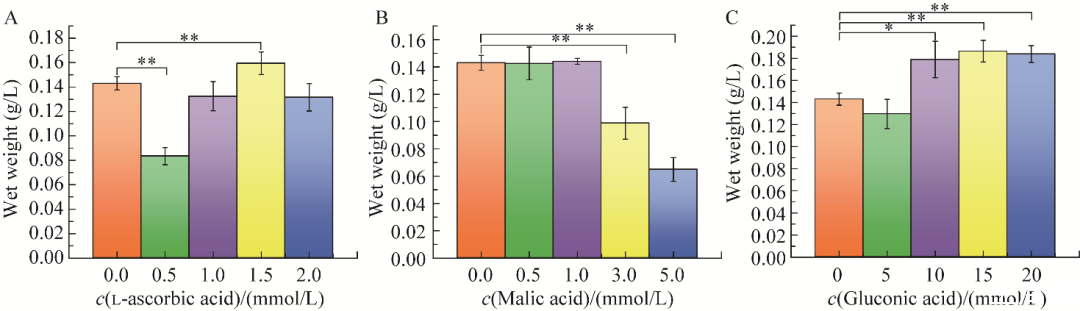
图4不同浓度有机物对Acidithiobacillus ferrooxidans BYM菌体浓度的影响A:l-抗坏血酸.B:苹果酸.C:葡萄糖酸.**表示P<0.01,*表示P<0.05
2.2不同有机物对Acidithiobacillus ferrooxidans BYM磁小体合成的影响
如图5所示,磁小体提取试验表明,1.0、1.5、2.0 mmol/L l-抗坏血酸添加组磁小体产量均高于未添加有机物组。1.5 mmol/L l-抗坏血酸添加组磁小体产量最高,为9.83×10−4 g/L(图5A)。1.0、1.5、2.0 mmol/L l-抗坏血酸添加组相较于未添加有机物组均存在极显著差异(P<0.01)。1.0 mmol/L苹果酸添加组磁小体产量最高为7.58×10−4 g/L(图5B)。0.5、1.0、3.0 mmol/L苹果酸添加组相较于未添加有机物组均存在极显著差异(P<0.01)。10 mmol/L葡萄糖酸添加组磁小体产量最高,为2.00×10−3 g/L(图5C)。5、10、15 mmol/L葡萄糖酸添加组磁小体产量与未添加有机物组相比均存在极显著差异(P<0.01)。同时,所有苹果酸以及葡萄糖酸添加组的磁小体产量均高于未添加组。
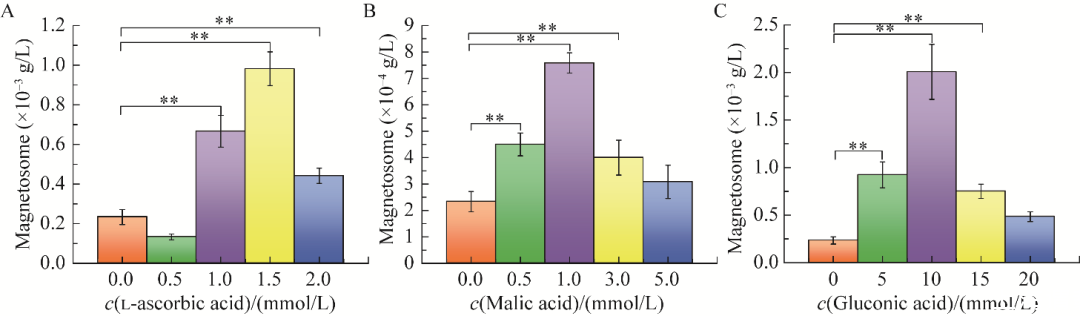
图5不同浓度有机物对Acidithiobacillus ferrooxidans BYM磁小体合成的影响A:l-抗坏血酸.B:苹果酸.C:葡萄糖酸.**表示P<0.01
2.3葡萄糖酸对Acidithiobacillus ferrooxidans BYM生长及磁小体合成的促进作用
根据上述试验结果选择10 mmol/L的葡萄糖酸进行A.ferrooxidans BYM发酵培养,以不添加有机物的A.ferrooxidans BYM作为对照组。葡萄糖酸作用前后菌体表观形态以及表面基团化结果如图6所示。SEM结果表明,添加葡萄糖酸组细菌呈椭圆形,表面光滑(图6A)。而对照组表面有褶皱,呈杆状(图6B)。TEM结果表明,添加葡萄糖酸组细菌胞内磁小体分散排列(图6C),数量明显高于未添加葡萄糖酸组(图6D)。
采用FTIR仪对添加10 mmol/L葡萄糖酸A.ferrooxidans BYM进行测试,如图7所示。以处于对数期的A.ferrooxidans BYM作为对照。
添加10 mmol/L葡萄糖酸组在3 402.02、2 926.84、1 652.82、1 536.74、1 236.29、1 079.29和614.31 cm−1处出现峰值。未添加有机物组在3 414.28、2 926.87、2 362.35、1 651.55、1 538.74、1 453.26、1 236.65、1 080.13和612.30 cm−1处出现峰值(图7)。通过与NIST数据库比较可知,经过葡萄糖酸处理后相较于未添加葡萄糖酸组在2 362 cm−1处少了一个峰,推测可能是C10H−。
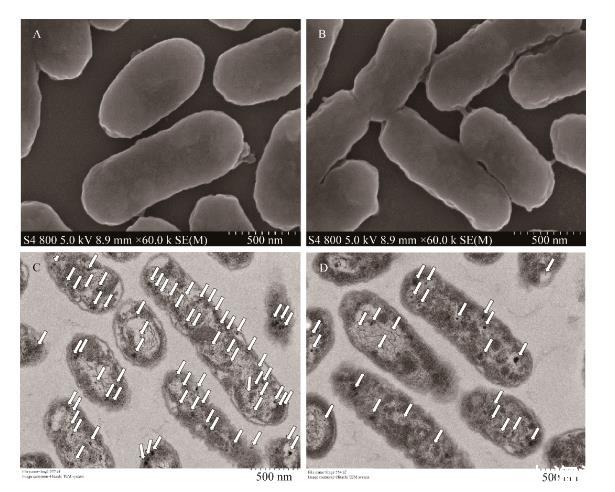
图6 Acidithiobacillus ferrooxidans BYM的扫描电镜图及透射电镜图A:500 nm标尺下的葡萄糖酸处理组扫描电镜图.B:500 nm标尺下的对照组扫描电镜图.C:500 nm标尺下的葡萄糖酸处理组透射电镜图.D:500 nm标尺下的对照组透射电镜图.箭头指向磁小体黑色颗粒
为探究A.ferrooxidans BYM发酵过程中菌体变化、磁小体生成以及亚铁消耗情况,选用菌体生长动力学模型建立最常用的是Logistic模型和Monod方程。Logistic模型是一个非常典型的S型曲线方程,常被用来描述菌体浓度与营养物质之间的非线性关系。因此A.ferrooxidans BYM菌体生长动力学模型选用Logistic方程进行拟合。利用1stOpt软件对试验数据进行非线性拟合,可得动力学参数为X0=0.010 5,Xm=0.165 2,μm=0.084 3。代入公式(2),整理可得A.ferrooxidansBYM菌体生长随时间变化的动力学方程,见公式(5)。

式中,X代表生物量(g/L),t代表发酵时间(h)。
由公式(5)所述动力学方程可知,随着发酵时间的延长,菌体湿重逐渐增加,将拟合得到的参数代入方程,得到R2为0.99,拟合结果良好,说明该模型能够很好地描述A.ferrooxidans BYM菌体生长过程。
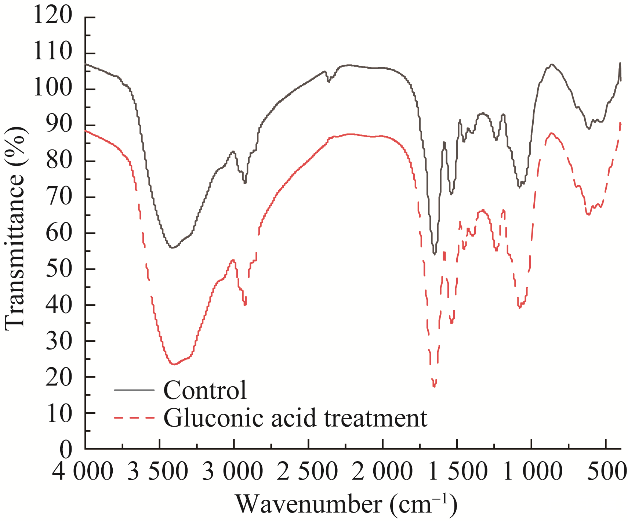
图7葡萄糖酸处理前后Acidithiobacillus ferrooxidans BYM的傅里叶变换红外光谱图
A.ferrooxidans BYM磁小体生成动力学为磁小体生物合成过程,选用Luedeking-Priet方程构建动力学模型,此方程能够准确描述出产物形成同菌体生长的相关性。利用1stOpt软件对不同发酵时间磁小体浓度进行非线性拟合,得到动力学参数为P0=0.000 1,α=0.000 9,β=0.000 2,代入公式(3),整理可得A.ferrooxidans BYM磁小体合成随时间变化的动力学方程,见公式(6)。
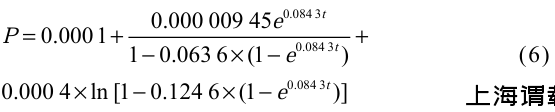
式中,P代表磁小体生成量(g/L),t代表发酵时间(h)。
由公式(6)所述的动力学方程可知,随着发酵时间的延长,磁小体的产量逐渐增加,将拟合得到的参数代入方程,得到R2为0.98,拟合结果良好,说明该模型能够很好地描述A.ferrooxidans BYM磁小体生成过程。
A.ferrooxidans BYM是以铁或硫为底物进行电子传递的微生物,并且仅在亚铁存在的情况下,A.ferrooxidans BYM才能合成磁小体。因此,本研究将FeSO4作为关键底物进行动力学分析。利用1stOpt软件对不同发酵时间的亚铁浓度进行非线性拟合,得到A.ferrooxidans BYM亚铁消耗动力学参数为S0=−0.995 3,a=0.029 0,b=0.000 3,代入公式(4),整理可得A.ferrooxidans
式中,S代表亚铁浓度(g/L),t代表发酵时间(h)。
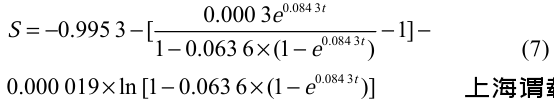
由公式(7)所述的动力学方程可知,随着发酵时间逐渐接近72 h,亚铁含量趋近于0,R2为0.98,拟合结果良好,说明该模型能够很好地描述A.ferrooxidans BYM亚铁利用过程。
10种有机物对氧化亚铁硫杆菌BYM磁小体生长、合成、发酵、产量的影响(一)
10种有机物对氧化亚铁硫杆菌BYM磁小体生长、合成、发酵、产量的影响(二)
10种有机物对氧化亚铁硫杆菌BYM磁小体生长、合成、发酵、产量的影响(三)
相关新闻推荐
1、林氏扇头蜱抗菌肽重组蛋白对大肠埃希菌生长曲线影响及抑菌效果(四)
3、DAPI荧光染色计数法:不同保藏方式时间对海洋微型底栖生物计数结果的影响——摘要、材料与方法
