利用CIRBP作为胰腺癌诊断及治疗分子标记物(细胞增殖生长曲线检测步骤)
RIP技术(RNABindingProteinImmunoprecipitation,RNA结合蛋白免疫沉淀),是研究细胞内RNA与蛋白结合情况的技术。运用针对目标蛋白的抗体把相应的RNA-蛋白复合物沉淀下来,然后经过分离纯化就可以对结合在复合物上的RNA进行分析;即用抗体或表位标记物捕获细胞核内或细胞质中内源性的RNA结合蛋白,防止非特异性的RNA的结合,免疫沉淀把RNA结合蛋白及其结合的RNA一起分离出来,结合的RNA序列通过microarray(RIP-Chip),定量RT-PCR或高通量测序(RIP-Seq)方法来鉴定;目标蛋白是一种应激反应蛋白,在应激反应过程中,可以从细胞核迁移到细胞质,此外,目标蛋白还可以从细胞中分泌出来,在细胞外作为损伤相关分子模式发挥功能,促进炎症反应,并在急性和慢性炎症中发挥重要作用。
一种利用CIRBP作为胰腺癌诊断及治疗分子标记物的方法,所述方法步骤包括如下:
步骤1:材料准备,准备试剂细胞培养试剂:胎牛血清,DMEM-高糖培养基,RPMI-1640培养基,青链霉素,PBS磷酸钾缓冲液,Trypsin-EDTA(0.25%)phenol red以及实验耗材6孔板细胞培养板,12孔板细胞培养板,24孔板细胞培养板,48孔板细胞培养板,96孔板细胞培养板,巴氏吸管;
步骤2:细胞复苏,将水浴锅预热至37℃,用75%酒精擦拭紫外线照射30min的超净工作台台面,在超净工作台中按次序摆放好消过毒的离心管、吸管、培养瓶等等,取出冻存管,迅速解冻,迅速将冻存管投入到已经预热的水浴锅中迅速解冻,并要不断的摇动,使管中的液体迅速融化,在冻存管内还存在一点点没融化的时候,取出,用酒精棉球擦拭冻存管的外壁,再拿入超净台内,制备细胞悬液,将细胞转移至一个15ml离心管内,一滴一滴地加入预热好的培养基,同时一边晃动离心管;加入培养基的量要达到10ml以上,离心,在低速离心机上,以800rpm离心5分钟;吸去上清,然后用1ml培养基重悬细胞,将细胞悬液分装入培养皿内,将培养皿放入37℃含CO2的培养箱内培养,换液的时间由细胞沉降速度情况而定;
步骤3:细胞培养,将水浴锅预热至37℃,用75%酒精擦拭紫外线照射30min的超净工作台台面,在超净工作台中按次序摆放好消过毒的离心管、吸管、培养瓶等等,取出细胞培养瓶,无菌操作,打开瓶盖,吸掉旧培养液,用PBS洗涤细胞一至二次,加入trypsin-EDTA溶液(1ml/25cm2,2ml/75cm2),轻洗细胞皿底部,吸掉trypsin-EDTA溶液,放入37℃培养箱2-3分钟,轻拍培养瓶壁使大部分细胞脱落,于倒立显微镜下观察,当细胞将要分离而呈现圆粒状时,加入适量含血清之新鲜培养基终止trypsin作用;
步骤4:实验分组,检测项目为RIP检测CIRBP调控TP53、、PCR检测CIRBP、TP53、wb、CIRBP、ACSL4、PTGS2、NOX1、GPX4、FTH1、普鲁士蓝染色、激光共聚焦检测线粒体活性氧ROS、谷胱甘肽GSH检测、流式凋亡检测、细胞增殖生长曲线检测;
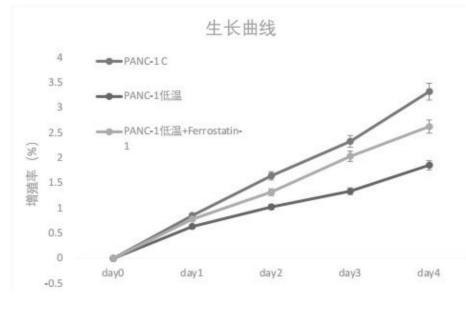
步骤4中细胞增殖生长曲线检测步骤为a:取各处理组细胞进行下面实验;b:消化细胞后吹打散细胞,计数,调整细胞浓度为1×105个/ml,分到96孔板,每孔100ul,即每孔细胞为1×104个;c:贴壁细胞需待细胞贴壁后,再收集各时间点细胞进行检测;d:收集各个时间点的细胞(0h,24h,48h,72h)加入CCK-8溶液(碧云天,Cat.No.C0037),比例为1/10。即100ul培养液加入10ul检测液;e:在孵育4小时后,酶标仪读板,CCK-8检测读取OD450数据。
步骤5:RIP检测P CIRBP调控TP53。
相关新闻推荐
1、小龙虾prx 6基因在对抗金黄色葡萄球菌感染中的分子作用机制
2、湖泊中细菌的多样性、与湖泊藻类爆发的关系及在湖泊污染治理中的应用
