探究P2Y2受体在人宫颈癌细胞(Hela细胞)增殖过程中的作用
随着人们生活节奏加快,子宫颈癌(cervical cancer)在中国女性群体中的发病率逐渐上升,已成为常见的妇科疾病之一,其发病率和死亡率已占世界的三分之一左右[1]。研究发现,子宫颈癌与HPV感染、p53和Rb失活、端粒酶激活、抑癌基因表达失常、癌基因激活和炎性细胞因子等密切相关,是多基因改变,多步骤发生的一类全身性疾病,其发病机制尚未完全明确[2-4]。P2Y2受体是G蛋白偶联受体家族的典型代表,广泛分布于正常组织中且具有组织特异性[5]。研究证明,P2Y2受体在多种癌症患者组织及细胞中均有表达,其中Kyse-140食管癌细胞系、T47-D乳腺癌细胞系及Hela子宫颈癌细胞系等均可特异性表达P2Y2受体[6-7],结合P2Y2受体其在介导癌细胞的增殖,分化和转移等方面发挥重要作用,提示P2Y2受体可能参与子宫颈癌病理生理过程。2-硫代-UTP是P2Y2受体的特异性激动剂,其可通过活化P2Y2受体激活下游信号转导系统,P2Y2受体活化后也可与其他受体相互作用,从而影响其自身与G蛋白发生偶联的能力[8-9]。P2Y2受体拮抗剂苏拉明可有效阻断P2Y2受体功能及其下游活动,进而抑制P2Y2受体介导的生物学效应[10]。本研究通过特异性拮抗剂和激动剂处理Hela细胞,在细胞水平上探究P2Y2受体在Hela细胞增殖过程中的作用,在研究子宫颈癌新型治疗靶点和手段等方面具有重要意义。
实验材料
人宫颈癌细胞(Hela细胞,KCB 86019YJ)由中国科学院昆明细胞库提供。DMEM培养基由HyClone公司提供,小牛血清由四季青生物工程材料有限公司提供,2-硫代-UTP和苏拉明由索莱宝生物科技有限公司提供,TNF-α和IL-6检测试剂盒由博士德生物工程有限公司提供,CCK-8细胞活性检测试剂盒由天根生化科技有限公司提供,山羊抗兔P2Y2多克隆抗体由Abcam公司提供,GAPDH单克隆抗体由北京中杉金桥生物技术有限公司提供,qPCR试剂盒由TakaRa公司提供,总RNA提取试剂盒及逆转录试剂盒由北京全式金生物技术有限公司提供。
实验分组
细胞所用培养基为DMEM完全培养基(含10%小牛血清和1%青链霉素混合液),实验分为3组,即:正常对照组、2-硫代-UTP处理组(50μmol/L)和苏拉明(100μmol/L)处理组,所用药物均用DMEM基础培养基稀释,所用细胞均控制在30代以内。
CCK-8法检测细胞活性
按照实验所设分组,用96孔板接种细胞,密度约为1×104/mL,每孔100μL,每组设置5个复孔,共接种3块孔板。细胞贴壁后行药物干扰,每间隔6h进行一次细胞活性检测,检测8次,共48h。CCK-8储存液按1:10的比例DMEM基础培养基稀释,细胞处理后更换CCK-8稀释液,每孔100μL,于37℃培养箱(5%CO2)孵育2h,450nm检测每孔的吸光度,以吸光度大小表示各组细胞活性,绘制细胞生长曲线。
细胞活性检测结果与生长曲线
各处理组细胞8个时间点的活性检测结果如表1所示,根据表1绘制细胞生长曲线(见图1)。结果显示,2-硫代-UTP处理组细胞较对照组生长速率明显加快,以第24h时间点生长速率出现最大值,且达到平台期所用时间也有所缩短。苏拉明处理组细胞生长速率均显著低于对照组和2-硫代-UTP处理组,且未出现细胞接触抑制现象。
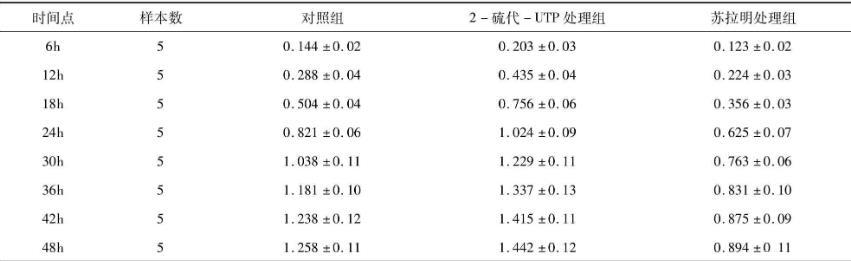
表1各时间点细胞活性检测结果(±s)
讨论
子宫颈癌是女性群体高发肿瘤疾病之一,仅次于乳腺癌,位列女性恶性肿瘤的第二位。中国是子宫颈癌高危大国,近年来其发病率和死亡率呈逐年上升趋势[1]。目前,子宫颈癌发病机制尚未完全阐明,探索新型有效的治疗靶点对防治子宫颈癌等疾病具有重要意义。P2Y受体家族是一类具有七次跨膜结构的G蛋白偶联受体,目前已从哺乳动物细胞中成功克隆出8种功能性P2Y受体亚型,I类受体包括P2Y1、P2Y2、P2Y、P2Y、P2Y,II类受体包括P2Y~P2Y[11-12]。
46111214近年来研究发现,P2Y受体家族尤其是P2Y2受体,在多种癌症组织和细胞中均有表达,并在癌细胞的增殖,分化和转移等活动中扮演重要角色[13-14]。根据不同时间点的细胞活性检测结果绘制各处理组细胞生长曲线,从中可以看出,正常生长的Hela细胞生长曲线呈典型的“S”状,而2-硫代-UTP处理组细胞指数生长期的斜率大于对照组,且其到达平台期所用的时间明显比对照组缩短,即2-硫代-UTP可通过激活P2Y2受体功能促进Hela细胞增殖。与之相反,经苏拉明处理后的细胞生长速率明显减慢,且细胞未达到接触抑制时即出现平台期,表明苏拉明通过阻断P2Y2受体功能可抑制了Hela细胞活性。
研究发现,P2Y受体激活后可进一步活化不同的G蛋白,进而引发复杂的信号转导途径[15]。P2Y2受体可通过激活Gq/11或Gi/o等类型的G蛋白,激活PLC途径,介导胞内Ca2+和炎性介质释放,进而激活下游NF-κB转录因子及CaMKII,最终产生促增殖效应或介导细胞凋亡[16]。也有研究认为,2-硫代-UTP可通过P2Y2受体引起APE1/Ref-1活化,或导致受体本身过表达[17]。从细胞生长曲线可看出,各处理组细胞均在第24h时间点生长速率达到最大值,因此我们选择检测第24h时间点各组细胞P2Y2受体表达情况。我们通过qPCR和Western blot实验确定了在Hela细胞中可表达P2Y2受体,且经2-硫代-UTP处理后的细胞中P2Y2受体mRNA和蛋白表达均明显增加,表明2-硫代-UTP在激活P2Y2受体功能的同时也可上调其受体本身的表达,而苏拉明处理组中以上指标均无显著变化。
ELISA结果显示,经2-硫代-UTP处理后的细胞IL-6水平明显升高,苏拉明处理组细胞也观察到了TNF-α释放量的增加。结合IL-6与细胞活化和增殖相关,尤其是其可作为生长因子刺激肿瘤细胞,特别是骨髓瘤细胞的增殖和迁移以及TNF-α能显著杀伤肿瘤细胞活性[18-19]等研究背景,推断P2Y2受体对Hela细胞活性的影响可能与其介导IL-6或TNF-α等炎性介质相关。
综上所述,本研究发现P2Y2受体功能激活能促进Hela细胞增殖,阻断其受体功能可显著抑制Hela细胞活性。这将为研究新型有效的抑癌靶点及探索子宫颈癌潜在的治疗手段等方面提供科学依据。
相关新闻推荐
2、高效萘降解菌N-3生长曲线、脱氢酶活性的测定——结果、结论
