短梗霉素A对植物病原真菌灰葡萄孢菌AUR 1基因的抑制生长机理(一)
通过考察短梗霉素A(Ab A)对灰葡萄孢菌野生株Bc AUR1及其AUR1基因内含子缺失突变株Bc AUR1a生长的影响,明确Ab A抑制真菌生长的机理。Ab A敏感性试验表明,低浓度Ab A(8μg/m L)显著抑制野生株Bc AUR1菌体的生长,高浓度Ab A(50μg/mL)存在下观察不到Bc AUR1的生长迹象。突变株Bc AUR1a则不受Ab A的影响,在低浓度和高浓度Ab A存在下均能正常生长。Ab A抑制Bc AUR1侵染柑橘果实,但Bc AUR1a在高浓度Ab A存在下也能够有效感染柑橘果实。这两个试验均证实了突变株Bc AUR1a具有Ab A抗性。电镜观察表明,Ab A引起Bc AUR1细胞质膜和内膜系统形态异常,质膜和液泡膜断裂,细胞内物质泄露。Ab A抑制灰葡萄孢菌生长的机制是由于IPC合成酶受到抑制,导致鞘磷脂类物质合成不足,细胞膜结构破坏,胞内物质外漏。
灰霉病由灰葡萄孢菌(Botrytis cinerea)侵染引起,是一种世界范围内的农作物及果蔬病害。灰葡萄孢菌的寄主范围很广,能侵染多种粮食作物、蔬菜、水果和观赏植物的叶、茎、花和果实。灰霉病不仅在田间造成危害,而且在贮运、销售和消费期间继续造成果蔬发病腐烂,严重影响产品产量和质量,造成很大的经济损失。目前化学防治仍然是灰霉病防治的主要措施,但由于灰葡萄孢菌具有遗传变异大、繁殖速率快和适应性强等特性,连续多年大量使用单一作用位点的杀菌剂,很容易形成对特定杀菌剂具有抗性的亚群体,其结果是防治效果下降,甚至失效。灰葡萄孢菌主要侵染果蔬的可食部分,杀菌剂的广泛使用,带来各种问题,如农药残留导致人畜安全受到威胁,伤害环境中其他微生物引起生态平衡失调等。人们一直试图寻找一种对真菌高效、与已有药剂没有交互抗性、对人类安全的新型杀菌剂。
鞘脂是真核生物细胞膜结构的重要成分,是维持真核细胞结构不可缺少的组分。近年来越来越多的研究表明,鞘脂及其代谢产物还是重要的信号分子,参与膜蛋白的定位和运输,并调节细胞的生长、分化、凋亡、衰老等基本生命活动。在鞘脂合成途径中,哺乳动物鞘脂类合成最终形成鞘磷脂,植物中形成复杂神经鞘脂质,而真菌最终形成甘露糖基化的肌醇磷酸神经酰胺。因此,神经酰胺和磷脂酰肌醇生成肌醇磷脂酰神经酰胺(IPC)和甘油二酯的反应是真菌鞘脂合成所特有的(图1)。催化这一反应的酶,肌醇磷脂酰神经酰胺合成酶(IPC合成酶)是鞘脂代谢中的关键酶,可作为筛选抗真菌药物的靶标。
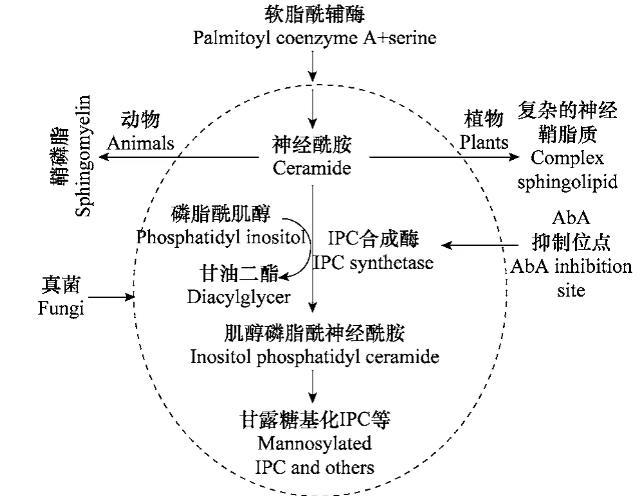
图1不同生物中鞘脂代谢途径
短梗霉素A(aureobasidin A,Ab A)是从出芽短梗霉(Aureobasidium pullulans)R106培养液中分离得到的环状九肽抗生素,对真菌和原生动物的生长有广谱抑制作用。现已证实Ab A是真菌AUR1基因编码的IPC合成酶的非竞争性抑制剂。Ab A处理和AUR 1基因表达抑制均引起酵母细胞形态和组织结构变化,如微管消失、细胞周期循环阻滞,细胞膜和内膜系统完整性遭到破坏等。通过在酵母等真菌中筛选抗Ab A突变体,发现突变体能抵抗Ab A引起的细胞形态和生长发育的异常,酵母AUR1基因158位的苯丙氨酸(Phe)突变为酪氨酸(Tyr)是获得Ab A抗性的分子机制。
迄今,对植物病原真菌灰葡萄孢菌AUR 1基因在生长发育过程中的作用了解甚少,本试验通过研究Ab A对灰葡萄孢菌及其突变体生长的影响,明确Ab A抑制真菌生长的机理,为真菌的防治和开发新型抗真菌药物提供理论依据。
1、材料与方法
1.1供试材料
1.1.1菌株
灰葡萄孢菌原始菌株Bc AUR1由浙江大学农业与生物技术学院李红叶教授实验室惠赠。灰葡萄孢菌突变菌株Bc AUR1a由本实验室以Bc AUR1为原始菌株,通过紫外诱变,Ab A筛选获得,经鉴定和序列测定发现,该突变菌株AUR 1基因序列中缺失117~231位115 bp的内含子序列,但AUR1基因编码的IPC合成酶的氨基酸序列未发生突变。
1.1.2培养基和Ab A母液配制
含Ab A的PDA培养基:待灭菌PDA培养基凉至50℃,依次加入Amp(终浓度为100μg/m L)和Ab A,使Ab A终浓度分别为2、8和50μg/m L,混匀后铺板;以相应浓度的甲醇代替Ab A,作为对照PDA培养基。
Ab A母液:Ab A购自宝生物公司,用甲醇配成浓度为2 mg/m L的母液,存储在4℃冰箱中,备用。
其他所有试剂均为分析纯。
1.2试验方法
1.2.1灰葡萄孢菌的培养
保存菌种用平板画线法接种于PDA培养基上,28℃恒温倒置培养一周,待其菌丝变为灰色并产生孢子,无菌水洗下孢子,调整孢子的浓度为1×107个/m L,4℃保存备用。
1.2.2灰葡萄孢菌对Ab A的敏感性测定
将野生型灰葡萄孢菌及其突变体的孢子悬浮液分别取100μL接种于对照平板和含不同浓度Ab A的PDA平板上培养6 d,观察菌落生长状况。
1.2.3灰葡萄孢菌侵染柑橘试验
先用清水将柑橘表面洗干净,然后在超净台中依次用无菌水、70%乙醇清洗,晾干。将柑橘分为4组,每组10个。用无菌针在柑橘表皮上刺1个1 mm左右的伤口,试验组在伤口表面均匀涂布5μL 50μg/m L的Ab A,晾干。对照组均匀涂布5μL2.5%甲醇。分别将5μL Bc AUR1和Bc AUR1a的孢子悬液(1×107个/m L)均匀涂布于对照组和试验组柑橘伤口处,置于保湿器皿中,室温(20±2)℃下培养4 d,观察感染情况。
1.2.4 Ab A对灰葡萄孢菌细胞形态的影响
分别将灰葡萄孢菌Bc AUR1孢子悬液接种于含8μg/m L Ab A的PDA平板和对照平板上,25℃培养3 d。用2.5%的戊二醛溶液4℃固定过夜,按常规透射电镜样品制备方法制备样品。将制备好的样品在Reichert超薄切片机中切片,获得70~90 nm的薄片,经柠檬酸铅溶液和醋酸双氧铀50%乙醇饱和溶液染色15 min后,在日本JEOL公司生产的JEM-1230型透射电镜中观察、拍照。
短梗霉素A对植物病原真菌灰葡萄孢菌AUR 1基因的抑制生长机理(一)
短梗霉素A对植物病原真菌灰葡萄孢菌AUR 1基因的抑制生长机理(二)
相关新闻推荐
3、肌苷对酸土脂环酸芽孢杆菌的生长抑制效果、对橙汁品质影响——讨论与结论
