基于水凝胶的快速液体噬菌体敏感性测定,通过液体生长测定来测量细菌生长
研究背景:噬菌体疗法是治疗抗生素耐药细菌引起的感染的一种替代方法。由于噬菌体的宿主范围狭窄,需要数百至数千个噬菌体才能覆盖细菌病原体的多样性。在个性化噬菌体治疗中,针对个体患者快速选择噬菌体对于成功治疗至关重要。本研究的目的是建立一种基于水凝胶的快速液体噬菌体敏感性测定(PST),用于选择用于治疗用途的噬菌体,并建立“即用型筛选”平板概念,其中噬菌体很容易储存在水凝胶中作为微量滴定板孔中的小液滴。
研究人员首先测试了四种市售水凝胶(GrowDex、Askina、Purilon和Intrasite)在具有四种噬菌体的PST中作为噬菌体基质的适用性,其中两种噬菌体感染大肠杆菌,两种噬菌体感染金黄色葡萄球菌。在这四种水凝胶中,GrowDex是PST的最佳基质,因为它不会抑制细菌生长,与细菌培养物混合时会快速释放噬菌体,并能很好地保持噬菌体活力。使用GrowDex作为矩阵,以代表10个不同物种的23种细菌菌株和具有不同形态和基因组大小的23种噬菌体,优化了光密度法(OD)和Biosense微生物动态监测系统(图像分析法)的测定。当用Biosense微生物动态监测系统监测细菌生长时,PST只需3小时即可完成,并且在测定前不需要过夜培养细菌细胞,而使用光密度法(OD)则必须将细菌预培养过夜,并且测定时间为五个小时。最后通过六种模型噬菌体进行为期六个月的稳定性测定,评估了三种不同化学稳定剂(海藻糖、透明质酸和明胶)的效果。这些噬菌体测定在化学稳定剂方面表现非常不同,并且没有一种稳定剂适合所有噬菌体。然而当使用明胶(0.01%)或透明质酸(0.2 mg/ml)作为稳定剂时,所有测试的噬菌体在1 ml体积储存六个月后在PST中仍然被认为是阳性。
oCelloScope微生物动态监测系统用于通过液体生长测定来测量细菌生长。为了测试细菌起始浓度和生长期对测定的影响,细菌在5 ml LB中预培养过夜,在1.3 ml LB中预培养两小时,直接从平板上挑取细菌接种到1 ml LB中被使用。用DSM细胞密度计测量细菌培养物吸光度(OD 600)调节至0.35并用LB稀释1:20至1:1000。将10µl液滴中的噬菌体裂解物(105-109 PFU/ml)添加到96孔微量滴定板的底部,然后添加200µl稀释的细菌培养物。作为对照,将200µl细菌培养物与10µl LB一起添加到孔中。将板用qPCR粘性透明板密封件覆盖,并在oCelloScope中于37°C下培养(无需摇动)。每30分钟至10小时采集一次图像。每个样品一式三份进行分析,并计算平均值和标准差。oCelloScope微生物动态监测系统测试方法的增强灵敏度使其能够记录比传统OD法小得多的细菌浓度变化。该方法可以在不使用过夜细菌培养物的情况下跟踪对数生长曲线(从而检测噬菌体感染)。为此使用过夜培养物稀释的细菌、三小时预培养物以及直接从平板培养物中挑选的细菌来接种生长曲线。
实验结论
开发了一种快速、耐储存的PST(快速液体噬菌体敏感性测定),它利用纳米原纤纤维素水凝胶和明胶作为噬菌体存储基质。使用Biosense微生物动态监测系统的基于图像分析法测量细菌生长时的检测时间短至三个小时,并且无需在检测前准备临床细菌的过夜预培养物。当以1 ml体积储存时,所有测试的噬菌体在水凝胶混合物中保持活力至少六个月,并以10µl液滴形式在“准备筛选”板中保持两个月。在准备筛选的平板中使用水凝胶作为噬菌体存储基质将能够快速高通量筛选噬菌体以进行个性化噬菌体治疗。
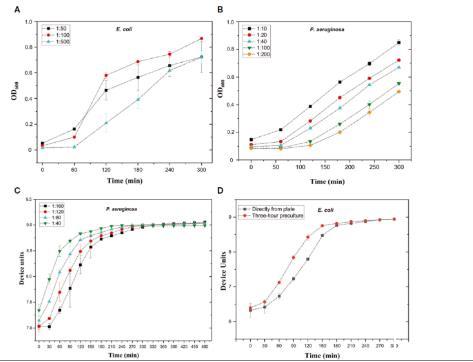
图1、使用光密度法(A、B)和oCelloScope微生物动态监测系统(C、D)优化细菌生长曲线。(A)光密度法中大肠杆菌菌株#5506的生长曲线。将过夜细菌培养物在溶源肉汤(LB)中稀释至1:50、1:100和1:500稀释度。将200µl体积的细菌稀释液添加到微量滴定孔板中,并使用吸光度读数器以600 nm处的光密度(OD)每隔1小时测量细菌生长,持续5小时。(B)吸光度读数器中铜绿假单胞菌菌株#6329的生长曲线。将过夜细菌培养物在溶源肉汤(LB)中稀释至1.10、1:20、1:40、1:100和1:200稀释度。将细菌稀释液以200µl体积添加到微量滴定孔板中,并按照A中的方法测量细菌生长。(C)使用oCelloScope微生物动态监测系统观察铜绿假单胞菌菌株#6329的生长曲线。过夜细菌培养物在LB中稀释至1:40、1:80、1:120和1:160。将200µl体积的稀释培养物添加到微量滴定孔板中。每隔30分钟跟踪一次细菌生长情况,持续8小时。(D)使用oCelloScope微生物动态监测系统观察大肠杆菌菌株#5521的生长曲线。细可预培养三个小时,也可以直接从平板上挑取并悬浮在LB中。将3小时预培养的OD调整至0.35并进一步稀释1:200,并将200μl稀释液等分到微量滴定板孔中。每隔30分钟跟踪一次细菌生长情况,持续5小时。
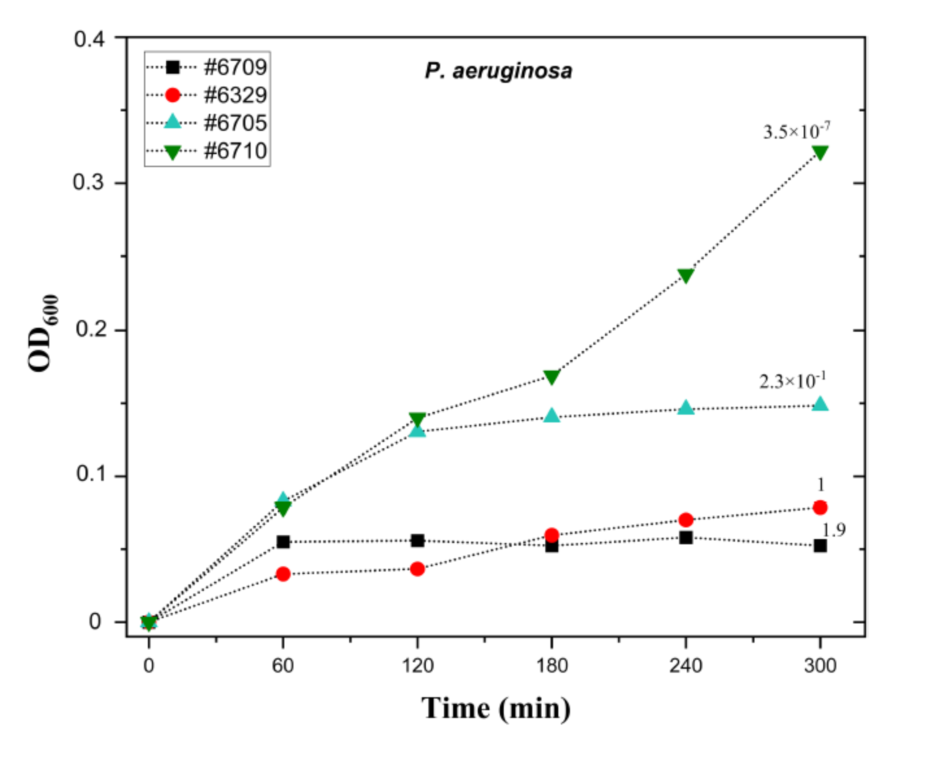
图2、液相噬菌体药敏试验与噬菌体PA8P1平板接种效率的相关性。将10µl PA8P1液滴(10 9 PFU/ml)转移到微量滴定板孔的底部。将铜绿假单胞菌菌株#6709、#6329、#6705和#6710的过夜培养物按1:40稀释,并将200µl细菌稀释液添加到孔中。将板在37°C和200 rpm下孵育,并以一小时的间隔测量600 nm处的吸光度。
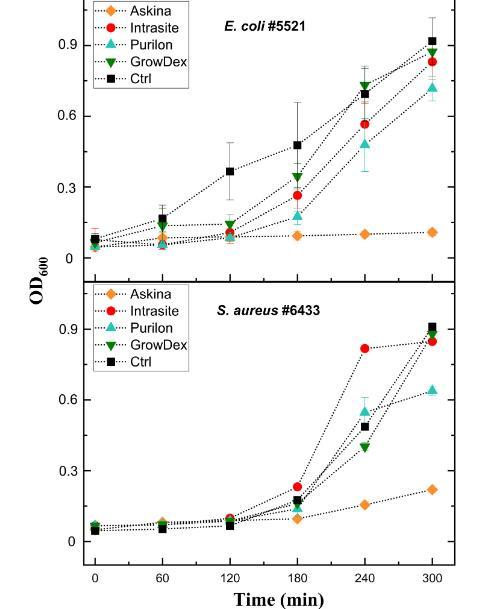
图3、四种商业水凝胶对细菌生长的影响。将水凝胶Askina、Intrasite、Purilon和GrowDex以10µl液滴的形式添加到微量滴定孔板的底部。过夜培养的大肠杆菌菌株#5521和金黄色葡萄球菌菌株#6433分别按1:500和1:100稀释。将200µl这些细菌稀释液添加到孔中,并将板在37°C和200 rpm下孵育5小时。以一小时的间隔测量600 nm处的吸光度。在不含水凝胶的溶源肉汤中生长的细菌作为对照。每个样品一式三份进行分析,并显示平均值和标准差。
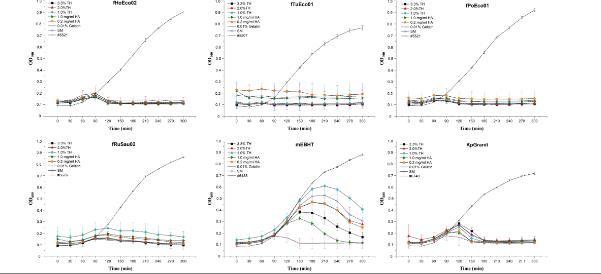
图4、使用在噬菌体-水凝胶组合物中储存六个月的噬菌体进行噬菌体敏感性测试。将噬菌体fHoEco02、fTuEco01、fPoEco01、fRuSau02、mEBHT和KpGranit与水凝胶以及3.3%、2.0%或1.0%海藻糖(TH)、0.2 mg/ml或1.0 mg/ml透明质酸(HA)、0.01一起保存%明胶,或不含稳定剂(SM),装在2 ml试管中,保存六个月。将10µl噬菌体混合物添加到微量滴定板孔的底部,并将200µl稀释的过夜细菌培养物添加到孔中。通过在600 nm处以30分钟的间隔测量光密度,持续5小时来跟踪细菌生长。所有测量均一式三份进行,并标明平均值和SD值。没有噬菌体的溶源肉汤中的细菌生长作为对照。
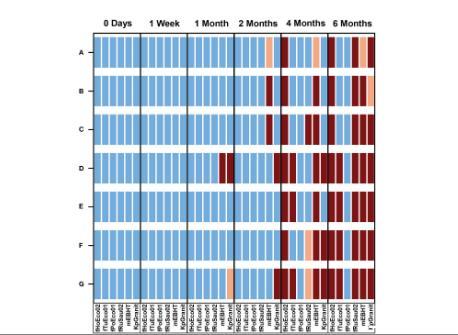
图5、使用在噬菌体-水凝胶组合物中储存六个月的噬菌体进行噬菌体敏感性测试。将噬菌体fHoEco02、fTuEco01、fPoEco01、fRuSau02、mEBHT和KpGranit与水凝胶以及3.3%、2.0%或1.0%海藻糖(TH)、0.2 mg/ml或1.0 mg/ml透明质酸(HA)、0.01一起保存%明胶,或不含稳定剂(SM),装在2 ml试管中,保存六个月。将10µl噬菌体混合物添加到微量滴定板孔的底部,并将200µl稀释的过夜细菌培养物添加到孔中。通过在600 nm处以30分钟的间隔测量光密度,持续5小时来跟踪细菌生长。所有测量均一式三份进行,并标明平均值和SD值。没有噬菌体的溶源肉汤中的细菌生长作为对照。
总结
自噬菌体发现以来,传统的PST方法尚未发生重大变化。传统方法(即双层琼脂测定)通常需要24至48小时,并且可能需要更长的时间,具体取决于噬菌体集合的大小和要筛选的临床细菌分离株的数量。一些用于斑块分析和定量的自动化工具已经发布。本论文研究人员创建了一种快速且强大的PST,可普遍用于许多临床相关的细菌物种。开发了一种基于水凝胶的液体PST,并用代表10个不同物种的23个细菌菌株和具有不同形态的23个噬菌体对其进行了优化。该测定法进一步用另外20种铜绿假单胞菌菌株和四种铜绿假单胞菌特异性噬菌体进行了验证。通过使用两种不同的方法,光密度法(OD)和图像分析法(Biosense微生物动态监测系统)来测量噬菌体感染时的细菌生长。本研究中研究人员开发了的这种利用水凝胶作为噬菌体基质的液体培养PST方法。该方法适用于传统OD读数器以及图像分析法(oCelloScope微生物动态监测系统)。但是使用OD读数仪进行检测时,需要对宿主细菌进行过夜培养,然后测试本身可以在五个小时内运行。而如果使用图像分析法(oCelloScope微生物动态监测系统),大多数测试的细菌物种不需要任何预培养步骤,并且只需三个小时即可完成测定。这种基于水凝胶的测定为大型和小型商业、研究和临床实验室提供了一种快速且自动化友好的方法,增强了对适合个性化鸡尾酒制备的噬菌体的选择,并减少了从实验室到临床的时间。
相关新闻推荐
1、不同种类、浓度可同化氮蓝莓果酒中酵母菌计数、生长速率(三)
