微生物生长曲线监测仪测定纳米银对副溶血弧菌的最小抑菌浓度(二)
1.3河口水样的采集、分析与处理
河口水采样点信息如表1所示,采集时间为2022年4月和12月,方法参照Das等的报道。简而言之,使用4 L柱式聚乙烯采水器在水面下10~15 cm处采集,然后装在洁净玻璃瓶中于室温下运输到实验室。为去除自然菌群的干扰,样品到达实验室后在121℃下灭菌30 min。然后于室温下密闭保存,使用前摇匀。
1.4EMGA法测定
如图1所示,EMGA法测定Ag NPs在河口水中抑菌效应的操作包括2个步骤:1)副溶血弧菌急性暴露于Ag NPs之后,暴露混合液加入预装有LB液体表1采样点经纬度信息培养基的检测管中;2)检测管置入EMGA中测定存活细胞的生长动力学曲线,从而示出最小抑菌浓度(minimum inhibitory concentration,MIC)。
具体如下:将10 8 CFU/mL副溶血弧菌接种到灭菌处理过的河口水样品中,使其终浓度为10 5 CFU/mL。然后各取10 mL分装入6个15 mL离心管中。分别加入倍比质量的Ag NPs,使该纳米材料的终浓度分别为0、1.5、3.0、6.0、12.0、24.0和48.0 mg/L。室温下,150 r/min轻摇离心管30 min,然后各取200μL暴露作用后的混合液分别注入预装有1.8 mL LB液体培养基的检测管(外径5 mm,NORELL公司,美国)中。以灭菌LB液体培养基作为阴性对照,同样装入检测管。将每个检测管分别插入EMGA的一个工作通道中,开启仪器,设置参数——激励电压12 V、激励频率400 MHz、采集周期1 min和采集次数1 200,点击“开始”键,EMGA即实时呈现所有检测管中细菌生长的动力学(ΔC 4-t)曲线。测定结束后,根据是否出现反正弦型生长曲线直接读出生理盐水中Ag NPs对副溶血弧菌的MIC值。
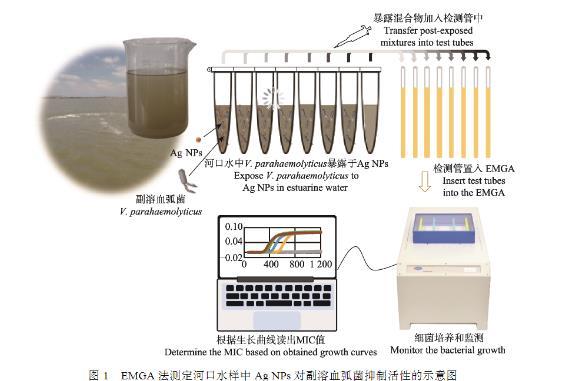
图1 EMGA法测定河口水样中Ag NPs对副溶血弧菌抑制活性的示意图
1.5BMD法测定
根据CLSI规定的BMD方法测定河口水中Ag NPs对副溶血弧菌的抑制效应。10 5 CFU/mL副溶血弧菌急性暴露于Ag NPs之后,将混合物装入离心管中,采用Optima XL-90型离心机(贝克曼库尔特公司,美国)处理5 min(3 000 r/min)以去除影响结果判断的悬浮颗粒。然后,各取20μL暴露作用后的混合液分别注入预装有180μL LB液体培养基的96孔板(Biosense微生物生长动态监测系统,丹麦)中。用封口膜封住96孔板以防蒸发。将96孔板放在培养箱中于36℃下培养20 h,取出后,通过肉眼观察是否浑浊判断是否有菌生长增殖,进而读出MIC值。
1.6平板计数法
测定参照Feng等报道的平板计数法测定河口水中Ag NPs对副溶血弧菌的抑制效应。10 5 CFU/mL副溶血弧菌急性暴露于Ag NPs之后,如无特殊说明,采用1.5部分述及的离心法除去混合物中的悬浮颗粒。然后,采用移液器各取100μL暴露作用后的混合液,10倍梯度稀释后,分别均匀涂在LB琼脂平板上。琼脂平板加盖后,在培养箱中于36℃下静止培养过夜,取出后,通过观察是否有菌斑生成判断细菌是否被完全抑制,进而判断出MIC值。
1.7数据处理与分析
以BMD法或平板计数法所测定的MIC值为相对标准,采用基本符合(EA)率值考察EMGA法测定Ag NPs抑菌活性的有效性。即将EMGA法测定的Ag NPs对副溶血弧菌的MIC值与平板计数法或BMD法所测定的MIC值比较,如果正负相差不大于1倍,则视作基本符合(EA);如果正负相差大于1倍而不大于2倍,则视作小偏差(mE);如果正负相差大于2倍,则视作大偏差(ME)。为了验证EMGA法的重现性和精密度,测定Ag NPs在河口水样S1中抑菌效应的实验做9个平行。采用Microsoft Excel2021处理数据以计算出平行实验结果的平均值和标准差(SD)。
