高产L-高丝氨酸的重组大肠杆菌的构建方法及应用
L-高丝氨酸(Homoserine,2-Amino-4-hydroxybutyricacid),是一种非蛋白氨基酸。可用于蛋氨酸、苏氨酸、胱硫醚、L-高丝氨酸内酯、γ-丁内酯、1,4-丁二醇、O-乙酰高丝氨酸与手性除草剂L-草胺膦等化学物质的生产,是一种极具潜力的中间体。L-高丝氨酸及其衍生物具有丰富的的生物活性,例如可提高植物的抗逆性,促进家禽生长,还可以有效地抑制镰状红细胞、并作为抗真菌药物,当前L-高丝氨酸的生产方法包括化学合成法、化学手性拆分法和生物法。
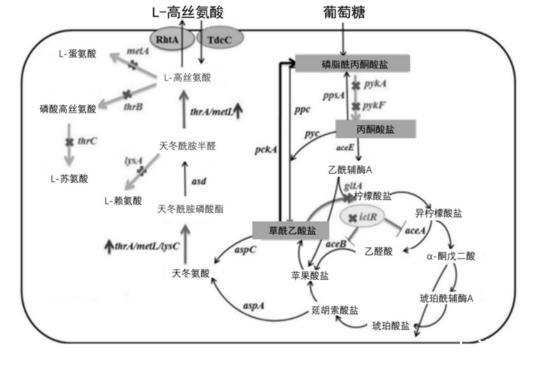
目前,化学合成法、化学手性拆分法和生物法来生产L-高丝氨酸,其中化学合成法使用的原料比较容易获得,收率较高,但是提纯步骤较为复杂,反应时间长,而化学手性拆分法指在混旋的高丝氨酸溶液中,加入手性试剂进行反应,使L/D-高丝氨酸性质发生差异,从而分离出L-高丝氨酸。该方法产率较低,由于在该过程中加入了大量的有机溶剂,因此会产生较大的污染,上述两种生产制备L-高丝氨酸的方式都存在较大弊端,随着微生物代谢工程的快速发展,在氨基酸工业生产中涌现大量以葡萄糖为原料的生产菌株,通过通过调控分支途径、不断优化合成代谢流、调节辅因子水平,以提高无质粒、非营养缺陷型菌株产量,但是通过生物方式生产L-高丝氨酸所采用的大肠杆菌Escherichia coli dh5aα由于在发酵中容易导致乙酰辅酶A的积累,使得柠檬酸循环的物质输入减少,且对乙酰辅酶A的利用能力较低,最终导致发酵生产的L-高丝氨酸的产量较低。
因此,为了解决上述技术问题本申请提出一种高产L-高丝氨酸的重组大肠杆菌的构建方法及应用。
一种高产L-高丝氨酸的重组大肠杆菌的构建方法操作步骤:
A:构建基因工程菌大肠杆菌,得到高产菌株Escherichia coli dh5aα,其具体的构建步骤为;
A1:使用菌株CRISPR-Cas9基因编辑技术敲除了旁路代谢的相关基因(metB、thrB、metA、lysA)和调节基因(metJ);
A2:将metL基因的天然启动子替换为Trc启动子,并且敲除转运基因metI构建得到了高产菌株Escherichia coli dh5aα;,
B:通过将ppc基因(编码磷酸烯醇式丙酮酸羧化酶)的天然启动子替换为Trc启动子,再通过质粒过表达了突变基因pyccg P458S(pyc*),基因ppc和pyc*分别编码磷酸烯醇式丙酮酸羧化酶和丙酮酸羧化酶,这两种酶可以减少乙酰辅酶A积累,增加柠檬酸循环的物质输入;
通过过表达thrAC1034T(thrA*)和lysCcg C932T(lysC*)基因,thrA*编码抗反馈抑制的天冬氨酸激酶Ⅲ和高丝氨酸脱氢酶Ⅰ融合蛋白,lysC*编码抗反馈抑制的天冬氨酸激酶Ⅰ,thrA*和lysC*的过表达将提高产物的合成速率,能减少草酰乙酸、柠檬酸等副产物的积累;
C:敲除乙醛酸途径转录调控因子基因iclR来强化乙醛酸循环,从而来强化菌株对乙酰辅酶A的利用能力,随后外源导入了蔗糖代谢基因,提高高产L-高丝氨酸的重组大肠杆菌利用蔗糖的发酵能力,通过以上步骤,得到高产L-高丝氨酸的重组大肠杆菌菌株;
需要说明的是,根据权利要求1所述的高产L-高丝氨酸的重组大肠杆菌菌株发酵L-高丝氨酸的应用具有如下步骤;
D:对高产L-高丝氨酸的重组大肠杆菌菌株进行菌种活化以及培养种子液,并将培养好的种子液以体积浓度5%的接种量接种至5L发酵罐发酵培养基上;
E:将活化完成后的高产L-高丝氨酸的重组大肠杆菌菌株接种至发酵培养基,在30℃、200rpm条件下发酵培养,将培养液分离纯化,获得L-高丝氨酸,并且为了在发酵过程中防止菌体污染,在培养基中添加了少量抗生素,并且为了提高L-高丝氨酸工程菌的生产性能,可通过加强更短、转化率更高的合成路径、优化中心代谢途径、调节辅因子水平、加快菌株生长等策略实现,其中需要说明的是,为了保障高产L-高丝氨酸的重组大肠杆菌菌株的活性,在进行种子培养时,需将高产L-高丝氨酸的重组大肠杆菌菌株暂存于-80℃的环境中;
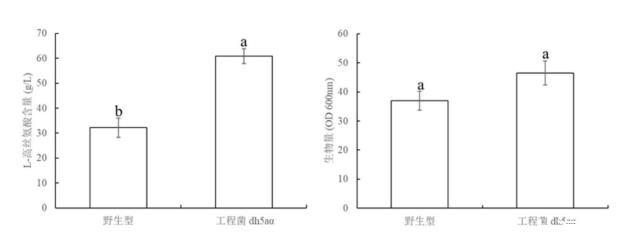
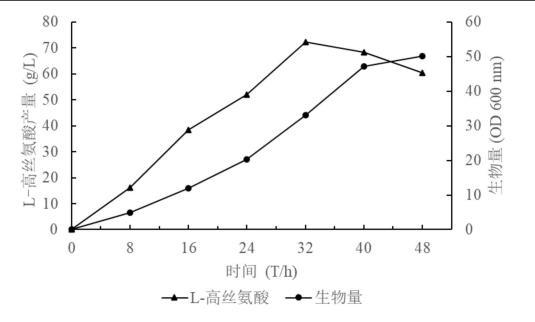
通过以上步骤,使用经过改造后的重组大肠杆菌相比于野生型能够更好地利用葡萄糖等碳源物质进行L-高丝氨酸的生产,并且能力更强,转化率更高;请参阅图2所示,经过改造后得到的性能最优的菌株在发酵生产L-高丝氨酸方面的水平相比于野生型有明显提升,5L罐发酵水平从32.17g/L提升至60.87g/L,产率提高了89.21%,并且由工程菌dh5aα的发酵生长曲线可知,在发酵32h后L-高丝氨酸产量最大,发酵产生的L-高丝氨酸的产量相较于通常情况下,生产效率更高,具有良好的应用推广价值;
在该方案的其中一个实施例中,对高产L-高丝氨酸的重组大肠杆菌菌株进行菌种活化和种子液的培养方法分为如下步骤进行;
D1:将高产L-高丝氨酸的重组大肠杆菌菌株接种在LB固体培养基平板上,在37℃培养箱中培养24h,实现对高产L-高丝氨酸的重组大肠杆菌菌株的活化操作,其中LB固体培养基平板的具体结构成分为蛋白胨10g/L、酵母粉5g/L、氯化钠10g/L,溶剂为去离子水,pH值自然。LB平板是在LB液体培养基中添加终浓度2g/L琼脂;
D2:挑取LB平板上长势较好的单菌落接种至LB液体培养基中,在37℃、200rpm的摇床中培养24h,获得种子液;
其中,所述5L发酵罐发酵培养基的具体物质组成包括葡萄糖40g/L、磷酸二氢钾2g/L、硫酸铵17g/L、酵母粉4g/L、碳酸钙20g/L、L-苏氨酸0.20g/L、L-蛋氨酸0.2g/L、维生素B1 0.0001g/L、维生素B1 20.000g/L、L-异亮氨酸0.2g/L、MgSO4 2g/L、FeSO4 0.005g/L、MnSO4 0.005g/L、ZnSO4 0.005g/L,去离子水1000mL,pH值为6.8,将适量经斜面培养基活化后的菌体细胞接种至装有2.5L种子培养基的5L发酵罐,流加氨水调节发酵液pH 6.8~7.2,溶氧维持20%~40%,通风量2~4m3/h,搅拌转速200~800r/min,35℃培养6h。以10%接种量将种子培养物接至装有3L发酵培养基的5L发酵罐进行发酵培养,发酵温度35℃,通风量2~4m3/h,搅拌转速300~900r/min,溶氧维持在20%~50%,流加80%的葡萄糖溶液,维持残糖质量浓度为1~3g/L,流加氨水调节发酵液pH6.8~7.2,发酵周期52h。利用H-10发酵时,接种后加入终浓度为0.05mmol/L的IPTG;
在发酵完成后,通过生物传感器分析仪测定葡萄糖含量。生物量以OD600nm计。采用高效液相色谱柱前衍生法测定L-高丝氨酸浓度。样品用2,4-二硝基氟苯衍生,以乙腈-水混合液(1∶1,V/V)和50mmol/L乙酸铵溶液为流动相,以1mL/min的流速梯度混合经过C18AAA色谱柱分离,最后在360nm波长处进行检测。
相关新闻推荐
1、传统腌干鱼制品中降解生物胺菌株的筛选、生长曲线及影响因素(一)
3、肌苷对酸土脂环酸芽孢杆菌的生长抑制效果、对橙汁品质影响——结果与分析
