瘢痕疙瘩MSCs生长曲线与发病机制研究(二)
2结果
2.1形态学特性原代分离培养的细胞初期大部分为小圆形细胞,培养24 h后大部分细胞死亡,只有少量细胞存活,且生长繁殖速度缓慢。细胞在经过1~2周的潜伏期后,细胞数迅速增多,形态呈梭形,放射状生长,倒置显微镜下可见多个细胞克隆,继续培养后细胞逐渐融合在一起,早期贴壁的细胞形态差异较大,有椭圆形、多角形和梭形等(图1A)。随着培养时间的延长,细胞形态逐渐变得均一,以长梭形为主。原代培养8~10 d后,改用低糖DMEM/(100 mL/L)得FBS培养基培养,经3~4 d培养后,细胞逐渐变的细长,分裂速度明显加快(图1B)。再改用低糖DMEM/(10 mL/L)FBS培养后,细胞形态变得更加均一,增殖速度更快,2~3 d就可以增殖2倍以上(图1C)。后改用无血清干细胞培养基培养,细胞趋于稳定,为研究MSCs的各种生物学特性的最佳时期(图1D)。
2.2细胞生物学标记物的检测MSCs高表达CD29、CD44、CD73,低表达或不表达CD45,第3代细胞表面标记物表达的比例:CD29为99.99%,CD44为99.7%,CD45为0.69%,CD73为99.96%(图2)。
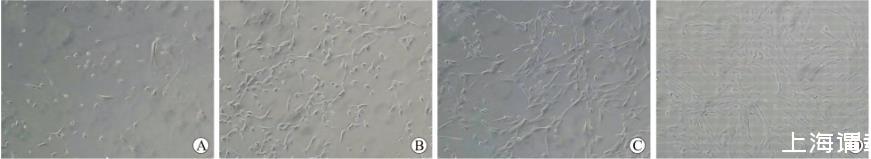
图1血清浓度逐步降低培养后的细胞形态
A:DMEM∶F12/(100 mL/L)FBS原代分离的细胞形态(8 d);B:低糖DMEM/(100 mL/L)FBS刺激后的细胞形态(14 d);C:低糖DMEM/(10 mL/L)FBS刺激后的细胞形态(17 d);D:无血清干细胞培养基中的细胞形态(19 d)。
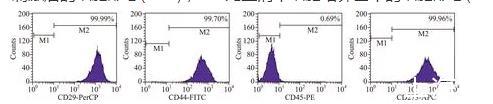
图2流式细胞术检测瘢痕疙瘩MSCs表面标志物的结果
2.3细胞生长曲线的绘制及特点第3代细胞生长曲线结果显示,最初的2 d细胞生长缓慢,但从第3天开始细胞数量明显增加,呈现对数生长,第7~8天以后细胞增殖变缓,形成一个平台期(图3)。
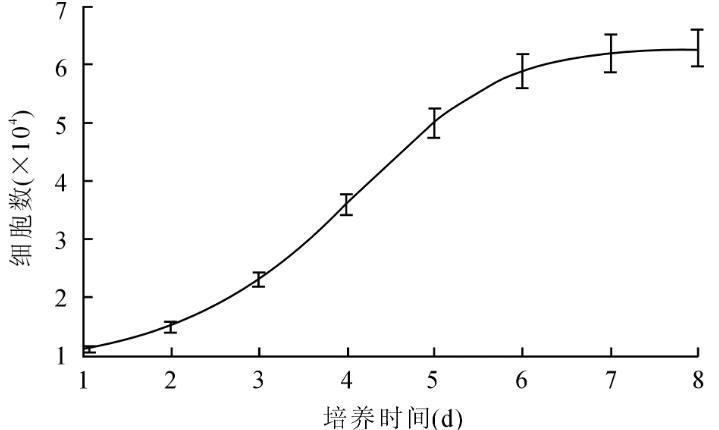
图3瘢痕疙瘩MSCs的生长曲线
3讨论
近年来国内外学者对瘢痕疙瘩的发病机制进行了深入研究,但其发病的实质仍未阐明,对MSCs的研究已成为瘢痕疙瘩发病机制研究的一个重要方向。IQBAL等[8]对瘢痕疙瘩皮损内和皮损外造血干细胞(haematopoietic stem cells,HSCs)和MSCs分布的研究发现,CD13+、CD29+、CD44+和CD90+的MSCs主要分布于皮损内,而CD34+、CD90+和CD117+的HSCs主要分布于皮损外。同时发现,在皮损内外还含有独特的CD34+细胞,这提示瘢痕疙瘩为非造血干细胞提供了适宜的生长环境。AKINO等[9]研究发现,瘢痕疙瘩来源的成纤维细胞能够诱导人MSCs向肌成纤维母细胞方向分化,这是终末分化成熟的成纤维细胞所不具备的属性,而具有分化潜能的MSCs可能在瘢痕疙瘩的发生发展中发挥重要作用。
迄今为止,体外分离培养MSCs还没有统一的方案,目前瘢痕疙瘩MSCs的分离主要借鉴正常皮肤MSCs的分离方法[6,10]。国内外一些学者也从瘢痕疙瘩中分离出了MSCs[11],但是分离的干细胞纯度不高,混有成纤维细胞等杂质细胞,给进一步研究的结果判断带来一定的干扰,因此分离高纯度的MSCs成为瘢痕疙瘩研究应首要解决的问题。
瘢痕疙瘩组织由于含有大量的胶原纤维,其质地比正常皮肤坚硬,在分离细胞时,首先将瘢痕疙瘩剪成小组织块的过程比正常皮肤要困难,需要细心和技巧,同时用胰酶消化的时间要进行摸索,消化时间过短,细胞分离不出来,消化时间过长,细胞损伤严重,无法贴壁。本实验经过探索选用2.5 g/L的胰蛋白酶37℃消化15 min后加含血清的培养液终止消化,可以达到较理想的效果。在细胞的后续培养中借鉴CARLSON[7]等关于小鼠心肌MSCs的培养方法,先用DMEM∶F12/(100 mL/L)FBS初步培养,再改用低糖DMEM/(100 mL/L)FBS培养,接着用低糖DMEM/(10 mL/L)FBS培养,最后用无血清的干细胞培养基培养。这种逐步降低血清浓度,形成血清的浓度梯度,在最初的培养中高浓度的血清有助于细胞贴壁和快速增殖,而随着血清浓度的降低,直至无血清培养,不但干细胞的分化受到抑制,而且可能由于缺乏某些营养成分,杂细胞的生长也得到抑制,从而得到高纯度的MSCs。此外,无血清干细胞培养基的细胞因子B27和FGF-2为MSCs生长所必须,而EGF和LIF则为非必须因子[6]。因此,无血清干细胞基础培养基中需加入含B27和FGF-2等因子的添加剂。瘢痕疙瘩MSCs在培养过程中特别容易污染,因此预防细胞污染对干细胞能否培养成功尤为重要。在实验过程中给干细胞培养基添加青霉素和链霉素,同时及时换液和传代,注意操作过程中的细节,比如在培养细胞时将手进行彻底消毒,禁止说话等可防止细胞污染。
对于MSCs的鉴定目前也没有统一的方法,迄今为止也没有筛选到用于鉴定MSCs的特异标记分子,也没有统一的命名[12-13],但不同来源的MSCs却有一些共同的标准,如CD13、CD29、CD44、CD73、CD105和CD166阳性,CD11a、CD14、CD34和CD45阴性[14-16]。本实验也采用多个表面标志组合进行鉴定,应用流式细胞术鉴定的结果表明瘢痕疙瘩来源的第3代纤维样细胞均高表达CD29、CD44和CD73等MSCs表面标记物,低表达CD45等造血干细胞表面标记物。MSCs具有向成脂肪细胞、成骨细胞和成软骨细胞等多向分化的能力,诱导分化实验虽然能够研究MSCs的多向分化潜能,但是不能提示细胞的纯度。因此,我们直接用流式细胞术检测细胞纯度。同时细胞生长曲线分析表明,MSCs在最初2 d为生长缓慢的潜伏期,随后细胞生长速度加快进入对数生长期,随着细胞密度的增大,第7~8天形成一个平台期。这说明本实验分离培养的MSCs增殖及活力良好,可用于下一步的实验研究。
本实验通过总结各种已报道的干细胞的分离培养方法,吸取各自优点并加以改进,分离培养出了纯度很高的瘢痕疙瘩MSCs,细胞形态为较均一的长梭形,与成纤维细胞类似,呈不规则放射状生长。这为下一步关于瘢痕疙瘩发病机制的研究打下了良好的基础。
相关新闻推荐
1、短梗霉素A对植物病原真菌灰葡萄孢菌AUR 1基因的抑制生长机理(二)
