菌株双控制生长开关及其应用的遗传稳定性(二)
3.具有双控制的生长开关能够获得较高的生产产量
研究人员用编码酵母中甘油合成途径基因的pUC57-Gly质粒转化WT、SC和DC菌株,分别得到菌株WT-Gly、SC-Gly和DC-Gly。这些菌株按照先前的实验方法进行培养。此外,我们在生长培养基中加入卡苄西林,以确保质粒的维持。去除IPTG后,SC和DC菌株生长停滞,取常规样品,测量甘油和葡萄糖浓度。
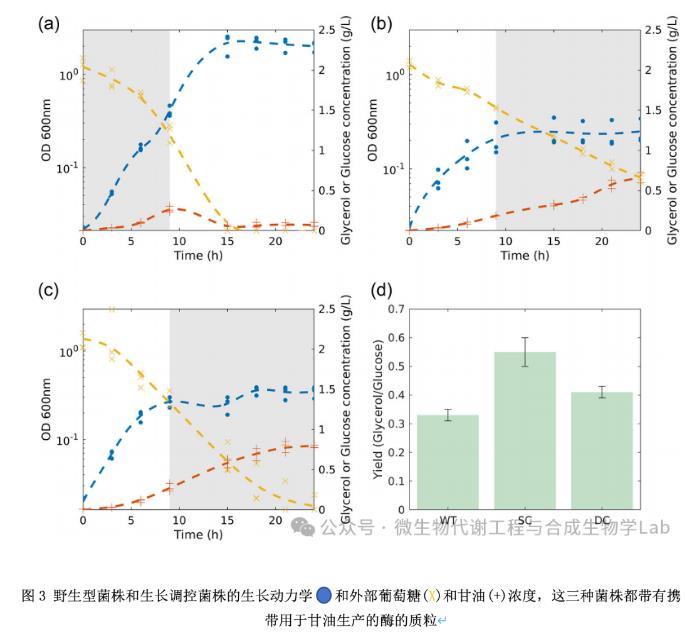
在WT-Gly菌株的情况下,葡萄糖在培养15小时后被完全消耗掉(图3a)。在葡萄糖的指数增长过程中,细菌产生甘油,甘油在葡萄糖耗尽后被同化。两种生长受阻的菌株消耗葡萄糖的速度较慢(图3b,c)。培养24 h后,SC-Gly菌株消耗了开始时供应的大部分葡萄糖,DC-Gly菌株消耗了实验开始时供应的所有葡萄糖。而且,这两种菌株都不能同化所产生的甘油。
大肠杆菌中的天然甘油消耗途径在葡萄糖存在下没有活性,这是由于甘油激酶的碳分解代谢物阻遏。此外,pUC57‐Gly质粒上携带的酵母甘油生产途径是不可逆的。因此,葡萄糖耗尽后甘油的同化需要在大肠杆菌途径中重新合成酶,由于RNA聚合酶表达抑制后转录活性的强烈降低,这在这个阶段不再可能。相比之下,葡萄糖摄取和代谢所必需的酶在实验开始时就已经存在了。
WT-Gly菌株的甘油产量定义为在细胞摄取葡萄糖的时间间隔内产生的甘油量除以消耗的葡萄糖量,为0.33ggly/gglc。为了计算SC-Gly和DC-Gly菌株的产量,在生长停滞后测定葡萄糖消耗和甘油产量。与预期的一样,生长抑制细菌的甘油产量分别高于WT细菌,分别为0.55和0.41。
尽管SC和DC这两种工程菌株之间有很小的差异,但一旦生长被关闭,DC-Gly菌株与WT-Gly菌株相比,甘油产量有显著改善。综上所述,在外部表达控制下添加rpoA的遗传冗余保留了资源从生长重新分配甘油生物合成的可能性。
4.具有双重控制的生长开关在遗传上是稳定的
生长停滞的菌株处于强大的选择压力下,任何恢复RNA聚合酶表达的突变体,即使是低水平的,也能够生长并最终接管种群。先验地,有两种方式可能损害生长开关的功能,并且细菌可以逃脱生长控制。首先,lacI序列的突变可能导致无功能的转录阻遏物。第二,T5启动子区的突变可能使LacI与T5启动子的结合效率降低。最初的SC设计中,通过在染色体中插入两个额外的lacI拷贝,可以大大降低第一个风险,而通过将单一控制进化为DC设计,可以解决第二个风险。在DC菌株的情况下,当细菌突变三个(天然和额外的)lacI拷贝或rpoA和rpoBC上游的两个lac操纵子序列时,才可以发生逃逸。
研究人员通过实验测试了DC菌株的遗传稳定性是否确实比SC菌株有所改善。对于这两种生长控制菌株,从分离的克隆中隆中进行了40次重复培养:在IPTG存在的情况下进行预培养,然后将预培养物洗涤并再稀释到不含IPTG的培养基中。使用丰富的(LB)培养基进行预培养,以获得大的种群,从而增加突变的可能性。让培养物进化,并在24小时和96小时后计算逃逸种群的数量。逃逸种群能够在生长停滞的条件下生长,即在没有IPTG的情况下生长。
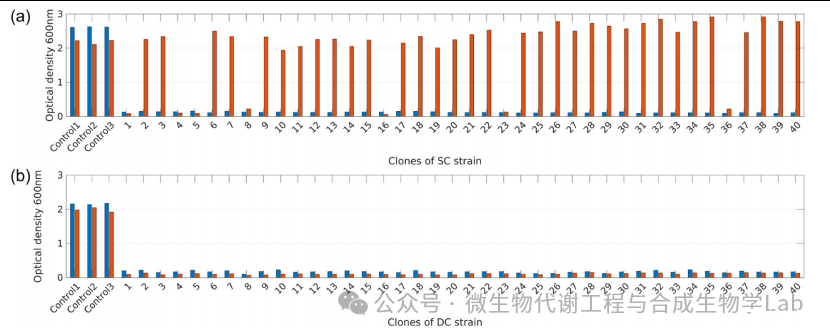
图4生长开关设计的遗传稳定性。通过对(a)SC株和(b)DC株进行40次重复培养,评估其遗传稳定性。对于每种培养物,测量了不同时间、24h(蓝色)和96h(红色)的光密度,并与WT对照的光密度进行比较
实验结果如图4所示。虽然在24 h后SC菌株没有检测到逃逸现象,但是超过80%的培养物达到了与培养96 h后WT菌株观察到的高光密度(图4a)。对一些但不是所有的这些逃逸子的测序显示了rpoBC启动子区域的关键突变。特别是,在LacI与启动子区域结合的一些lacO序列中发现了核苷酸替换。之前有报道称,这些替换导致LacI的结合亲和力更低,在原始序列亲和力的<1%到2%之间。由于这些突变,即使在没有IPTG的情况下,rpoBC操纵子也可以表达。相反,无论是在24h后还是在96 h后,DC应变都没有发生逃逸现象事件(图4b)。这表明,与原有生长开关的单对照设计相比,改进后的双对照设计的遗传稳定性有了很大的提高
5.双控制生长开关稳定性的提高并不会降低其生存能力
DC菌株的遗传稳定性是通过进一步修改细菌的必要转录机制获得的。这些额外的修饰可能会影响细胞的活力,即一旦诱导剂在一段时间的生长停滞后被重新供应,它们就具能重新开始生长。在生长阶段和生产阶段之间进行迭代的可能性在生物技术过程中是很重要的。因此,研究人员对SC和DC菌株进行了活性试验,并比较了结果。
通过经典的扩散平板法评估了生长受阻细菌的生存能力。在24小时后,取SC和DC群体的常规样本,在相同的IPTG培养基中预培养后,再稀释到含葡萄糖和不含IPTG的M9培养基中。样品被稀释到已知的生物量,并分散在含有IPTG的固体琼脂平板表面。对单个菌落进行计数,并在每个时间点通过将每生物量CFU与在相同培养基中使用IPTG的同一菌株的每生物量CFU归一化来量化其活力。
图5具有单控制(SC)或双控制(DC)生长开关的菌株的生存能力。活力表示为SC菌株(橙色)和DC菌株(蓝色)的每克生物量CFU与在相同条件下使用IPTG生长的同一菌株的每克生物量CFU的归一化
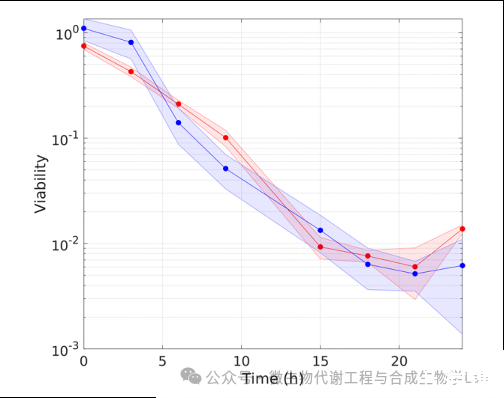
从图5中可以看出,SC和DC菌株的生存能力评分没有显著性差异。对于两株菌株,在没有IPTG的情况下,活力呈指数下降,15 h后稳定在0.01左右。这意味着,与在IPTG存在下生长的相同菌株相比,只有1%的细胞在长时间的生长停滞后能够恢复生长。相反,在相同的IPTG条件下培养的SC和DC菌株恢复生长的能力并没有随着时间的推移而下降。
讨论:
生物具有通过突变和适应约束而进化的能力。对于世代时间短、种群规模大的细菌来说尤其如此,这使得它们能够快速进化。虽然这一特性在自然界中是相关的,但当涉及到用于生物技术应用的修饰细菌菌株时,它提出了一个挑战。由于微生物本身就不稳定,容易出现意想不到的行为,因此可能导致工程遗传功能的丧失。有害突变的发生对于控制细菌生长的合成回路尤为重要,因为失去控制可能会在生长受阻的种群中带来明显的适应度优势。
为此,研究人员基于之前的生长开关,添加了RNA聚合酶的另一个亚单位α被置于用于控制ββ’亚单位表达的同一lac系统的控制之下,从而显著增加了生长开关及其应用的遗传稳定性。
在生长和生长停滞之间转换的可能性提高了持续代谢物生产的前景,包括生物量产生之后、生长停滞和代谢物生产的周期。当生物过程在恶劣条件下进行时,所提出的方法特别有益,因为RNA聚合酶调节可以提高细胞对酸性、高温和高盐浓度的耐受性。然而,为了使生长和生长停滞的重复循环实际可行,需要用其他方法取代IPTG的化学诱导,例如光遗传学。此外,还可以控制生物合成途径的表达,以强调生长和生物合成之间的解离。这可以通过一个正交的表达系统来实现,如T7RNA聚合酶,这将允许细胞继续合成生物合成所需的酶,即使生长受到抑制。此外,使用最优和反馈控制方法与光遗传诱导相结合,可以精确确定生长和生长停滞阶段的持续时间,从而获得产量和生产力之间的预期权衡。通过对RNA聚合酶的冗余控制而获得的生长开关的稳定性增加,是通过这些扩展实现对代谢物生产的连续、动态控制的必要前提。
