甘露聚糖对S.cerevisiae酵母菌株生长及抗氧化活性的影响(二)
2结果与分析
2.1甘露聚糖对酿酒酵母菌株生物量和活力的影响
由图1可知,与对照相比,甘露聚糖有效延长了酒精发酵过程中S.cerevisiae菌株的对数生长期和稳定期。随着甘露聚糖浓度的增加,S.cerevisiae菌株生长越快,当质量浓度大于300 mg/L时,促进作用较MP3处理组降低。
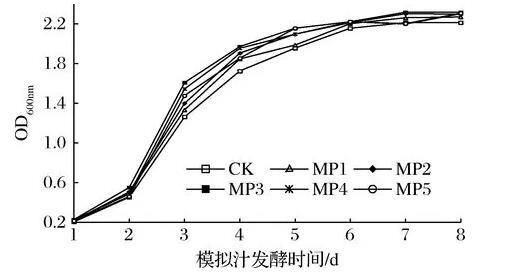
图1甘露聚糖对酿酒酵母菌株生物量的影响
由图2可知,MP3处理组比对照组显著增加了酵母活力(P<0.05),尤其使酒精发酵前期和中期的葡萄糖诱发质子流(glucose induced proton electric,GIPE)值增加了8.2%和10.1%;MP1和MP2处理组,对不同酒精发酵时期酵母菌株活力无显著差异(P>0.05);MP4和MP5处理组,在酒精发酵初期反而降低了酵母活力,故选择200、300、400 mg/L的添加量测定S.cerevisiae细胞通透率及抗氧化指标。
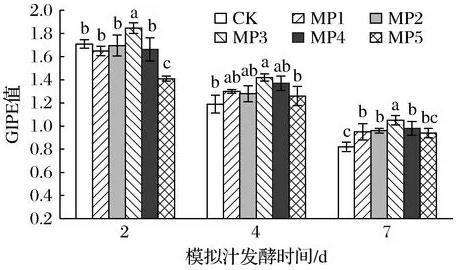
图2甘露聚糖对酿酒酵母菌株活力的影响
2.2甘露聚糖对酿酒酵母细胞中ATP酶活性的影响
ATP又称能量货币,是细胞内能量的主要载体。而ATP酶是真核细胞在有氧条件下产生细胞ATP的重要酶,存在于组织细胞膜上,在物质运送、能量转换及信息传递方面具有重要作用[13]。由图3所示,随着酒精发酵的进行,酵母细胞中ATP酶活性呈下降趋势,是由于酒精发酵过程中产生酒精、有机酸等物质使酵母的生存环境逐渐恶劣,细胞活力逐渐下降。与对照相比,甘露聚糖的添加显著增加了酒精发酵不同时期酵母细胞中ATP酶的活性。在酒精发酵第3天时ATP酶活性由高到低分别为MP3(21.25 U/mg)>MP2(18.81 U/mg)>MP4(17.07 U/mg)>CK(15.35 U/mg),MP3处理组较对照组增加了39.1%(P<0.05)。综上所述,在酒精发酵前添加甘露聚糖有利于提高酵母细胞中ATP酶的活性,尤其是在酒精发酵中期,增加了酵母细胞的抗逆性反应。
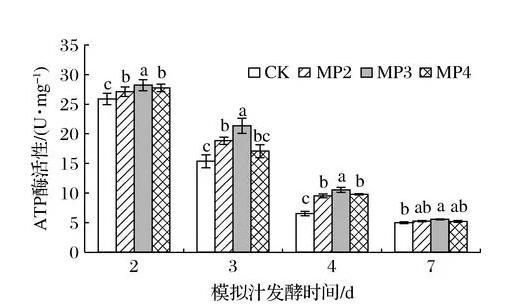
图3甘露聚糖对酿酒酵母细胞中ATP酶活性的影响
2.3甘露聚糖对酿酒酵母细胞中SOD活性的影响
酵母可以通过多种途径保护自身免受各种胁迫(包括氧化应激),清除H2O2、超氧阴离子自由基等[3],如通过抗氧化酶,包括SOD、CAT、GSH-Px等的水平来体现对氧化应激的适应性反应;也可以通过产生GSH清除溶液中的氧化剂,从而提高细胞的抗氧化水平。图4为酒精发酵前添加不同浓度的甘露聚糖对酵母细胞中SOD活性的影响。由图4可知,随着酒精发酵的进行,酵母细胞中SOD活性呈下降趋势。在酒精发酵不同时期对照组与处理组SOD的活性均无显著性差异(P>0.05),可见甘露聚糖的添加并未对S.cerevisiae细胞中SOD活性产生影响。
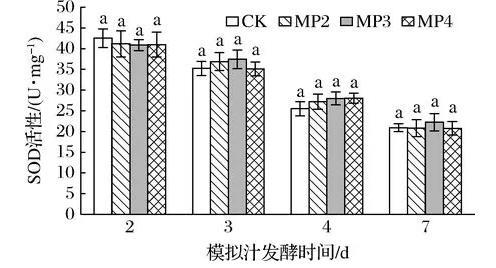
图4甘露聚糖对酿酒酵母细胞中SOD活力的影响
2.4甘露聚糖对酿酒酵母细胞中活性氧的影响
少量ROS是酵母菌株正常生理代谢所必需的[14-16]。但酵母细胞内ROS过量积累会导致细胞损伤甚至死亡[17-19]。由图5可知,在酒精发酵过程中,酵母细胞中的ROS先上升,随着酒精发酵末期酵母的死亡而快速降低,在酒精发酵进行的第2、3、4天中处理组都显著低于对照组。在酒精发酵第4天,MP3处理组中ROS含量较对照组显著降低了27.5%;酒精发酵末期处理组与对照组无显著差异。综上所述,甘露聚糖有利于降低酒精发酵前期和中期S.cerevisiae细胞中的ROS含量,且MP3处理组酵母细胞ROS含量最低,有利于降低酵母细胞结构的损伤,提高S.cerevisiae菌株抗逆性。
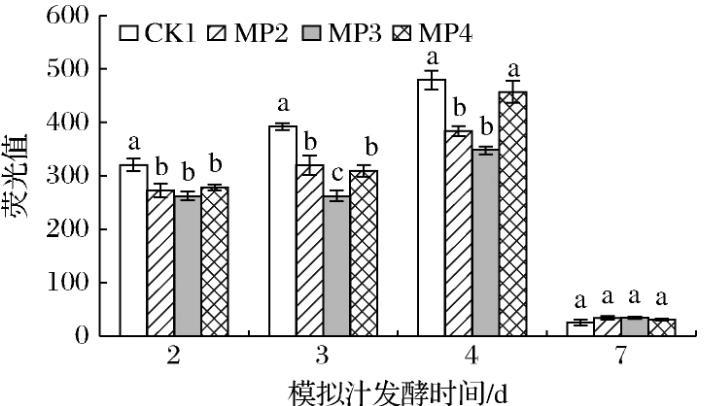
图5甘露聚糖对酿酒酵母细胞中ROS的影响
2.5甘露聚糖对酿酒酵母细胞中丙二醛含量的影响
MDA是ROS作用于脂质发生过氧化反应的终产物之一,通常将其作为膜脂过氧化作用强弱的一个重要标志[20]。由图6可知,在酒精发酵过程中,S.cerevisiae细胞中MDA逐渐积累,且在酒精发酵第4天后,MDA含量大幅增加。在酒精发酵前期处理组与对照组不存在显著差异,是因为在对数增长期酵母发酵活力良好。酒精发酵第4天时,MDA含量为MP2(7.05 mg/g)
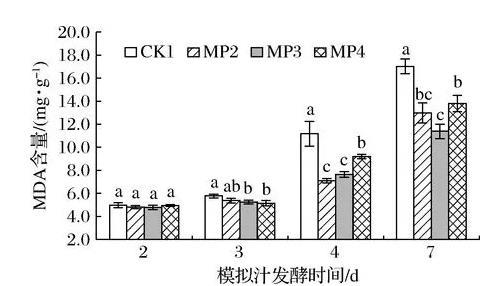
图6甘露聚糖对酿酒酵母细胞中MDA含量的影响
2.6甘露聚糖对酿酒酵母细胞和模拟汁谷胱甘肽含量的影响
在生物体内起重要生理作用的是GSH,它与氧化型谷胱甘肽一起维持和调节细胞的氧化还原状态[21-22]。它是一种内源性抗氧化物质,在葡萄酒酒精发酵期间,能够有效防止葡萄酒中酚类物质的氧化,保护葡萄酒的芳香物质和色泽[23]。由图7可知,酵母细胞中GSH含量在酒精发酵前期到中期呈上升趋势,而在酒精发酵中期到后期呈下降趋势,可能是由于酒精发酵初期酵母生存环境较好,未激发细胞的抗逆性反应。在酒精发酵初期,处理组酵母细胞中GSH含量与对照组不存在显著性差异,而在酒精发酵的中期和后期GSH含量明显增加。酒精发酵第3天时MP3处理组GSH含量最高,达到99.33 mg/g,较对照组增加了21.9%。第4天时细胞中GSH含量为MP3>MP2>MP4>CK,MP3处理组为62.26 mg/g,与对照组相比显著增加了24.2%;酒精发酵末期,MP3、MP2和MP4处理组酵母细胞中GSH含量较对照组增加了70.1%、51.9%和31.9%。由图8可知,与对照组相比,处理组模拟汁中GSH含量在酒精发酵的不同时期均高于对照组,但均未达到显著性差异。综上所述,在酒精发酵前添加甘露聚糖可显著促进酵母细胞中GSH的合成,而对胞外GSH的分泌影响较小。因此,添加酵母多糖可增加酵母菌株的抗氧化能力,且添加质量浓度为300 mg/L时效果最佳。
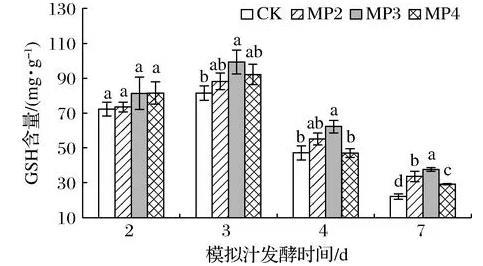
图7甘露聚糖对酿酒酵母细胞中GSH含量的影响
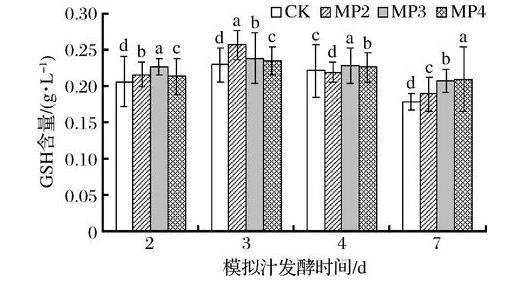
图8甘露聚糖对模拟汁中GSH含量的影响
3讨论
卢新军等[23]指出,在酒精发酵过程中添加酵母细胞壁提取物可促进S.cerevisiae的生长繁殖,减轻乙醇对酵母的抑制甚至毒害作用,促进酵母的生理活性及生长代谢。ALSTEENS等[24]研究表明酵母细胞壁提取物可以通过提供不饱和脂肪酸和甾醇等营养物质促进葡萄汁和麦芽汁的快速完全发酵。NGELES等[25]研究表明酵母提取物中的主要活性成分是甘露聚糖,它可通过清除有毒的发酵产物,如中链脂肪酸或赭曲霉毒素A等,减少这些物质对酵母菌株的抑制作用,增加酵母菌株活力。郭守东[26]也在相关的研究结果中得出类似的结论。LUBBERS等[27]指出中链脂肪酸可以穿过酵母细胞质膜,使细胞质中ROS积累,导致酵母细胞结构受损,发酵活力降低。本研究结果表明,甘露聚糖可缩短S.cerevisiae菌株生长的迟滞期,有利于酵母菌株的快速适应和生长繁殖,对细胞活力具有显著的提升作用(P<0.05)。
S.cerevisiae菌株在酒精发酵过程中会产生的乙醇、毒素等物质能抑制酵母菌株的代谢,使酵母细胞中ROS积累,从而破坏S.cerevisiae细胞结构的完整性,导致其代谢活力下降[28]。本实验研究发现在酒精发酵前添加甘露聚糖,使酵母细胞中ATP酶活性显著增加,ROS和MDA含量降低,GSH含量增加,且添加量为300 mg/L效果最好。SIES[29]指出,细胞自身防御氧化的途径主要有2条,其中酶系防御体系主要通过抗氧化物酶清除自由基,如SOD、CAT等,而非酶系防御体系主要是通过产生GSH和金属硫蛋白等还原性物质与自由基发生氧化还原反应来清除自由基,进而保护细胞不被氧化。结合本实验中甘露聚糖能促进细胞中GSH的合成,表明甘露聚糖可能是通过非酶系防御体系途径来提高S.cerevisiae细胞抗氧化性。有研究发现胶红酵母粗多糖纯化后各组分对羟自由基和超氧阴离子自由基具有很强的清除能力,且效果高于维生素C[30]。研究还发现甘露聚糖可以清除ABTS阳离子自由基、羟自由基、DPPH自由基、超氧阴离子自由基和螯合Fe2+[8]。以上研究都是从清除自由基的基础上研究多糖的抗氧化性,本实验证实了甘露聚糖可通过增加ATP酶活性和GSH含量,并清除ROS和MDA含量来提高抗氧化性,提高S.cerevisiae的细胞活力。
4结论
本实验以模拟葡萄汁为原料,研究甘露聚糖对S.cerevisiae菌株生长及抗氧化活性的影响。结果表明,甘露聚糖在S.cerevisiae菌株酒精发酵的全过程中均对酵母细胞活力具有显著的提升作用(P<0.05);外源添加300 mg/L甘露聚糖的处理组中酵母细胞的ATP酶显著高于对照组(P<0.05),而SOD活性不存在显著差异(P>0.05);在酵母菌株生长中后期,外源添加甘露聚糖的处理组中ROS、MDA含量显著低于对照组(P<0.05),并且酵母细胞内的GSH含量显著高于对照组(P<0.05),即添加甘露聚糖可通过促进酵母细胞中GSH的合成来清除细胞内过量的ROS、MDA,提高酵母细胞的抗氧化能力,并且质量浓度为300 mg/L时抗氧化能力最强。
酵母相关文章:
微生物生长监测系统应用:酿酒酵母II号染色体合成及生长曲线图分析
