微生物合成食品功能因子方法、研究策略和进展(一)
随着社会发展和人们对安全、健康、营养饮食的追求,功能性食品的研发成为食品领域的研究热点[1].其中,食品功能因子是功能性食品制造的基本原料,也是赋予食品特定生理功能的关键成分.食品功能因子种类丰富[2],根据其化学结构主要分为11类:活性多糖,功能性低聚糖和功能性单双糖,功能性脂类,糖醇类,多糖类,氨基酸、肽与蛋白质,维生素和维生素类似物,矿物元素,植物活性成分,益生菌和低能量食品成分.这些功能因子在调节人体机能,改善睡眠和促进生长发育等方面发挥重要作用.
合成生物学作为一种更安全、更健康和绿色可持续的食品获取方式,为功能性食品组分和重要功能营养因子的生产提供了技术支撑,成为推动食品行业发展的重要手段.以大肠杆菌(Escherichia coli,E.coli)、枯草芽孢杆菌(Bacillus subtilis,B.subtilis)、谷氨酸棒杆菌(Corynebacterium glutamicum,C.glutami cum)和酿酒酵母(Saccharomyces cerevisiae,S.cerevi siae)等为代表的典型模式微生物具有生长速度快、营养要求简单、遗传操作简便和工业发酵培养模式相对成熟等优势[3,4],已广泛用于合成各种生物能源和生物医药等[5~7],同时在食品领域也被开发用于高效合成各种营养组分,如N-乙酰氨基葡萄糖[8,9]、母乳中的关键成分2′-岩藻糖基乳糖[10]、血红蛋白[11]以及乳蛋白[12]等.其中,细胞的生长调控是实现高效生物制造的关键控制点,因此以模式微生物底盘细胞作为食品功能因子的合成载体,充分利用合成生物学原理和技术对细胞的生长进行有效精细调控,有望实现食品功能因子的高效合成.本文主要从转运蛋白工程改造提高菌株生长速率、重编程细胞能量代谢、细胞生长与产物合成偶联以及细胞生长与产物合成解偶联四个方面系统总结了目前基于模式微生物生长调控合成食品功能因子的研究策略和进展(图1),并指明微生物合成食品功能因子面临的挑战及未来发展方向,以期为功能因子的高效生物制造提供新思路.
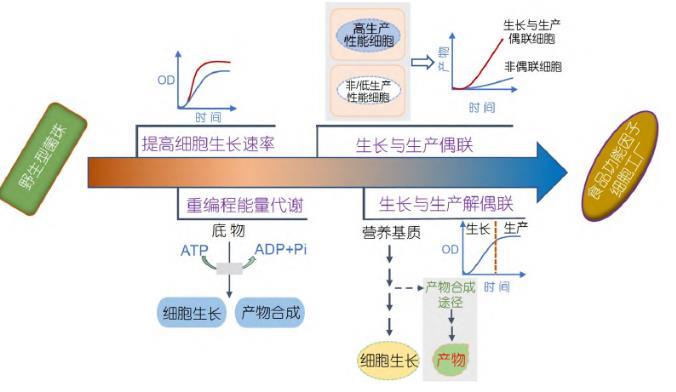
1优化底盘细胞生长速率
发酵过程中微生物有效吸收和代谢关键营养基质的能力直接影响细胞的生长.因此,提高碳源利用率或扩大可利用碳源的范围能够优化底盘细胞的生长速率,增加细胞密度,从而实现食品功能因子的高效合成[13].
1.1碳源转运蛋白工程
微生物可以利用多种碳源,它们对碳源的选择主要取决于胞内相关碳源转运蛋白的表达,因此高效表达碳源转运蛋白是提高碳源利用率的一种直观快速方法.研究较为广泛的是S.cerevisiae[14~18]和E.coli[19~23]中的各种内源和外源糖类转运蛋白.S.cere visiae对己糖特别是葡萄糖的转运机制已被很好地表征,它通过内源的Hxt家族己糖转运蛋白介导的转运系统来利用己糖[18,24].目前,已鉴定出约20种编码己糖转运蛋白的Hxt基因,研究表明,通过调节一种或几种转运蛋白的表达可提高细胞对葡萄糖的摄取能力,以S.cerevisiae CEN.PK m850作为出发菌株,经过改造使其具备乳酸合成能力,乳酸的生产强度为0.77 g/(L h),后通过强化HTX1基因的表达,提高菌株对葡萄糖的消耗速率,使得乳酸生产强度达到(0.85±0.02)g/(L h)[25].考虑到发酵成本和环境保护等因素,越来越多的糖组分成为微生物可利用的替代碳源[26].在无特异性转运蛋白存在时,添加非天然碳源会明显减弱底盘细胞的生长速率.而Wang等人[27]通过引入低亲和力的阿拉伯糖转运蛋白araE基因,使得S.cere visiae在以蔗糖为碳源的培养基中高效合成白藜芦醇,产量达2.3 mg/L.因此,研究人员可通过引入外源转运蛋白或改造内源Hxt转运蛋白,使得S.cerevisiae在以蔗糖、果糖或纤维二糖等非天然碳源为营养基质的条件下进行有效生长,从而赋予其高产果聚糖[28]、柠檬酸[29]等食品功能因子的能力.Bruschi等人[30]在不能以蔗糖为碳源的E.coli基因组上整合表达蔗糖利用基因表达盒,发现菌株以蔗糖为碳源和以葡萄糖为碳源时的生长速率一致,这为以蔗糖或含蔗糖的廉价原料为碳源有效合成产品提供了可能.一方面,通过调节转运蛋白表达强度或继续挖掘其他碳源转运蛋白有利于提高碳源摄取率并扩大可利用碳源种类,从而改善底盘细胞的生长性能和生产潜力.另一方面,转运蛋白可能受到转录因子及其效应物的调控[31,32].因此,深入了解其调控机制可为合成食品功能因子底盘细胞的改造提供理论依据.
1.2适应性实验室进化
适应性实验室进化(adaptive laboratory evolu tion,ALE)是一种在特定生长环境或选择压力下,通过长期培养筛选获得具有某种更优特性菌株的技术.它无需深入了解细胞错综复杂的代谢网络,只需根据目标表型设计选择压力来筛选获得较优突变株,具有适用范围广、实用性强等优点[33~35].适应性实验室进化已被广泛用于优化微生物底盘细胞的生长表型,以改善菌株的生产性能[36~39].B.subtilis作为GRAS(generally recognized as safe)菌株,已广泛用于高效合成多种功能性低聚糖[40,41]、功能性单糖[42]及蛋白质[43]等食品功能因子.Liu等人[44]将野生型B.subtilis 168在M9基本培养基中传代超过1000代,进化菌株A40的比生长速率提升43.5%,乙偶姻和卵清蛋白生物合成分别提高54.5%和20%.多层次组学技术可用于阐明进化株的进化机制及其基因型和表型之间的关联,后者可用于指导构建或优化高效合成目标产物的细胞工厂.LaCroix等人[45]对E.coli MG1655进行为期81天的进化后获得一株生长速率提高1.6倍的菌株.全基因组测序发现,主要是pyrE/rph基因间隔区、全局转录基因rpoB和DNA结构基因hns/tdk间隔区发生突变,pyrE/rph突变与菌株的嘧啶生物合成相关.经转录组学分析,rpoB和hns/tdk突变导致与蛋白合成、葡萄糖转运和糖酵解途径相关基因的表达水平上调,增加中心碳代谢途径的通量,从而提高底盘细胞的生长速率.研究表明,C.gluta micum在以葡萄糖为唯一碳源的基本培养基中经过1500代培养后,其生长速率提高了42%.经基因组测序和反向代谢工程发现,转录调控因子GntR1和RamA的突变导致菌株生长性能的改善[46].因此,适应性实验室进化结合组学分析可鉴定出提高底盘细胞生长适应性的关键突变点,有助于实现食品功能因子的高效生物合成.
适应性实验室进化也可被用于优化微生物对碳源的摄取率,或者扩大微生物对替代碳源,如木糖、乙酸盐和柠檬酸盐等的利用范围以提高细胞生长速率[34,47].木糖作为木质纤维素中含量第二丰富的糖类,如何高效转化为功能营养品等高附加值产品是研究热点.Promdonkoy等人[48]在以木糖作为唯一碳源的培养基中对S.cerevisiae进行适应性实验室进化,提高了其对木糖的摄取能力,并鉴定出一株生长速率提高58%且异丁醇产量提升110%的菌株.Seong等人[49]以E.coli DSM01作为出发菌株,在以乙酸钠为唯一碳源的M9培养基中传代培养4 0天后获得一株生长速率为0.14 h−1的进化株,而DSM01在该培养条件下几乎无法生长.随后验证该进化菌株合成萜类化合物中间体甲羟戊酸(mevalonate,MVA)的能力,MVA的生产强度达到1.32 g/(L h),相比出发菌株提高14.3倍,这加速了乙酸盐作为碳源生产功能营养品、生物燃料和重组蛋白等的研究进展.适应性实验室进化也可用于实现微生物对混合碳源的吸收利用.例如,Reider Apel等人[16]对引入木糖利用途径的S.cerevisiae BY4742菌株以木糖为碳源进行培养进化,进化后菌株经全基因组测序,发现己糖转运蛋白HXT7(F79S)发生突变,该突变一方面提高了S.cerevisiae在以木糖为唯一碳源时对木糖的摄取率,从而展现出显著的生长;另一方面,在存在双碳源——葡萄糖和木糖时显示出可同时利用两种碳源的优良特性,从而减少培养时间并提高生产效率.由此可见,适应性实验室进化可以有效提高微生物对不同底物的利用率和对环境的适应性,进化得到的高生长速率底盘细胞在改善产物合成方面具有很好的潜力(表1).
适应性实验室进化与合成生物学和系统生物学工具相结合是一种优化菌株表型和性能的有效策略,删除有害突变、保留有益突变可重构性能优异的微生物底盘细胞.适应性实验室进化通过非直观的方式提高微生物的适应性,但是由于突变本身很难达到精准预测,同时较长的进化周期可能导致错失获得最优表型的突变株.而基因组规模代谢模型[62~64]可揭示表型与基因型的相关性并用于预测生理变化,两者相互结合补充可以更好地用于优化菌株表型或开发新的微生物平台.
相关新闻推荐
1、脓肿分枝杆菌胞内菌落计数、对RAW264.7细胞血红素氧化酶1调控自噬影响(一)
2、牦牛源短小芽孢杆菌生长曲线测定及药敏试验、体外抑菌结果解读(二)
