微生物合成食品功能因子方法、研究策略和进展(二)
2重编程细胞能量代谢
能量代谢在细胞生长和中心代谢途径中发挥重要作用,操纵能量代谢是优化微生物生长适应性和实现产物高产量、高产率和高生产强度相统一的有效策略[65,66].ATP作为最重要的能量来源,调控ATP供应是调节细胞工厂代谢流分布、生物量积累和产物合成的重要手段[67,68].有氧条件下细胞主要通过氧化磷酸化途径合成ATP,因此操纵该途径可以有效调节细胞内ATP的浓度,其中主要通过调控NADH水平、ATP合酶活性和电子传递链来调节ATP代谢.
2.1调控NADH供给
细胞内NADH主要来源于糖酵解、脂肪酸氧化和三羧酸循环,所以可以根据NADH代谢来调控NADH相关酶的活性进而调节胞内ATP水平.Zhu和Shimi zu[69]敲除E.coli中编码丙酮酸甲酸裂解酶的pfl基因,从而导致胞内NADH/NAD+比率显著升高,ATP/AMP水平降低,同时在以葡萄糖为碳源时菌株的糖酵解通量显著增加.研究人员通过调控E.coli TCA循环中相关基因的表达,增强了TCA循环的碳通量和胞内ATP水平,导致β-胡萝卜素[70]和番茄红素[71]产量显著增加.为实现异丁醇的快速高效生产,研究人员对合成异丁醇的B.subtilis进行代谢网络分析,揭示了NADPH对异丁醇生物合成的重要性[72].因此在氧化还原失衡且NADPH过量的情况下,强化表达来源于E.coli的udhA基因提高胞内NADH和ATP浓度,最终细胞生长性能得到优化,异丁醇产量提高.敲除S.cerevisiae中消耗NADH的乙醇脱氢酶的同时过表达生成NADH的乙醛脱氢酶,可提高胞内NADH的水平和甘油的产量[73].此外,在培养基中补充依赖NAD+脱氢酶的相关底物[74],可以有效调控胞内ATP浓度,从而提高产物合成效率.通过调控NADH供给实现上调或下调胞内ATP水平的策略较为清晰简便,且调控效果显著,但NADH浓度的变化可能会破坏胞内氧化还原的平衡,因此需要考虑细胞的氧化还原状态是否利于产物合成.
2.2调控F0F 1-ATP合酶表达
在氧化磷酸化过程中,电子传递链产生的质子动力通过ATP合酶驱动ATP生成,因此操纵F0F 1-ATP合酶表达是调控ATP水平最直接有效的方法.在E.coli中强化ATP合酶基因操纵子的表达提升胞内ATP水平,可有效提高β-胡萝卜素的产量[70].Zhang等人[75]在S.cer evisiae中表达来源于拟南芥(Arabidopsis thaliana)的ATP6基因,提高了ATP水平;后将该基因在产朊假丝酵母(Candida utilis)中进行表达,提高了胞内F0F 1-ATP合酶的活性和胞内ATP水平,同时菌株的生物量提高且S-腺苷甲硫氨酸和谷胱甘肽的合成增强[76].
由于ATP合酶的F1亚基具有水解ATP的功能,因此表达该亚基会促进ATP水解从而降低ATP的浓度.在E.coli中表达ATP合酶的F1亚基降低了胞内ATP水平,并显著提高菌株对葡萄糖的摄取速率和乳酸合成能力[77].利用类似的策略,在糖多孢红霉菌(Saccharopo lyspora erythraea)表达F1亚基导致较低的[ATP]/[ADP]比,维持了细胞的氧化还原平衡状态,红霉素合成能力提高28%[78],同样该策略提高了乳酸乳球菌(Lactococ cus lactis)的乙偶姻合成能力[79].因此对于可产生质子动力的菌株,操纵ATP合酶活性可有效调控胞内ATP的供应,并改善生产菌株生物量的累积和与ATP合成相关的目标代谢物的生产.
2.3调控电子传递链
在氧化还原反应中,电子传递链上电子转移过程中产生的质子梯度可用于胞内ATP合成.在有氧发酵中,氧气是电子传递链的最终电子受体,因此氧气浓度是影响胞内ATP含量的关键因素[80].尤其是某些高密度、高能量的发酵体系中氧气的丰度是ATP合成的重要条件[81].调控发酵罐的搅拌速度或在发酵过程通入氧气是较为简单的氧气供给策略[82].另一种策略是添加一定浓度的正己烷、正庚烷、血红蛋白和正十六烷等携氧载体,该策略也可提高氧浓度[83~86].E.coli发酵过程中血红蛋白的添加使细胞生物量提高约11%[85].Li等人[86]在培养基中加入正十六烷,促进S.cerevisiae胞内ATP积累,S-腺苷甲硫氨酸的产量达到2.27 g/L.此外,调控pH维持在酸性条件下可以提高胞内ATP水平.因为较低pH产生的质子梯度可驱动呼吸链中的F0F 1-ATP合酶活性[87,88].虽然通过调控电子传递链可以调节ATP代谢,但由于其涉及多个基因的调控,难以通过简单的单基因或几个相关基因的调控来调节胞内ATP水平.
ATP作为一类重要的辅因子,对代谢反应的速率、细胞的生长和产物合成具有重要的调控意义.胞内ATP水平对不同产物的影响不同,胞内高浓度的ATP可以促进多糖等食品功能因子的合成[89],而谷氨酸等代谢物的合成则需要维持低浓度ATP,因此需要平衡宿主胞内ATP水平和细胞生长之间的关系,从而实现产品的高效合成.
3细胞生长与产物合成偶联
采用传统微生物代谢工程策略对细胞工厂进行改造可能会导致代谢通量失衡或代谢负担,从而使得细胞生长性能受损和生产性能减弱,特别是具有高度工程化或遗传回路的微生物往往会在长期发酵中失去生产表型[90,91].为了解决该问题,一种策略是将细胞生长与产物合成相偶联,使生产适应细胞的生长,实现生长和产物合成之间的平衡[92,93].
3.1营养缺陷系统与产物合成偶联
营养缺陷与产物合成进行偶联是一种生长与生产偶联的方法,其中产物合成对于细胞生长是必需的.Atsumi和Liao[94]在异亮氨酸营养缺陷型E.coli中引入柠苹酸途径合成α-酮戊二酸,从而为1-丙醇和1-丁醇的合成提供前体,且α-酮戊二酸可进一步转化为异亮氨酸,使得该菌株能够恢复生长能力,但生长速率仍低于直接添加异亮氨酸的情况.后对该途径的关键酶CimA进行定向进化,筛选得到生长速率高于野生型的突变株,并显著提高1-丙醇和1-丁醇产量.Ye等人[95]发现,合成番茄红素的S.cerevisiae在继代培养时出现白色菌落,猜测可能是由于GAL调控系统的破坏导致途径基因转录被抑制从而不能合成番茄红素,所以出现菌株表型退化的现象.菌株是需要表达URA3才能正常生长的尿嘧啶缺陷型菌株,编码番茄红素合成的基因由GAL启动子驱动表达.为了实现生长与合成偶联,研究人员利用GAL启动子同时控制URA3和番茄红素途径基因的表达,从而导致在长期培养中GAL系统破坏的菌株无法正常生长.当葡萄糖存在时,葡萄糖诱导的启动子PH XT1开启URA3的表达,细胞正常生长.当葡萄糖耗尽时,PG AL启动子激活产物合成相关基因和偶联的URA3基因表达,从而赋予生产细胞生长优势.将该策略用于S.cerevisiae高效合成(+)-瓦伦亚烯,产量达到16.6 g/L.
此外,研究人员拓展了模块化细胞(modular cell,MODCELL)[96]的设计原理以优化生长偶联效果.模块化细胞是一种营养缺陷型细胞,包含必要但不足以支持细胞生长和维持代谢的中心代谢途径,因此必须与可变的产物合成模块偶联.该模块可以辅助细胞生长,维持细胞代谢并增强产物的合成,通过优化两者之间的偶联强度可以快速筛选最优生产宿主,并通过乙醇的生物合成进行了验证[97].
3.2基于群体质量控制和代谢产物成瘾系统的生长与产物合成偶联
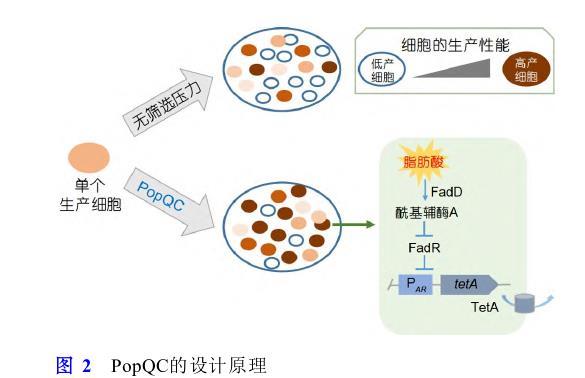
代谢负担常常导致生产细胞表现出降低的生长适应性,由于遗传和不可遗传变异导致的非生产细胞亚群由于缺乏代谢负担而恢复生长适应性,并可以快速占据细胞群体,从而降低生产能力[98,99].对抗代谢异质性的一个策略是将代谢产物的合成与细胞生长进行偶联,从而解决非生产亚群导致的细胞群体生产能力流失的问题.对此,Xiao等人[100]提出了群体质量控制系统(population quality control,PopQC)的概念.首先在E.coli中开发一种基于调控因子FadR且响应目标产物的生物传感器,该传感器响应游离脂肪酸的浓度,在低产细胞或者非生产细胞中转录调控因子FadR与PA R启动子结合,抑制编码四环素外排蛋白基因tetA的表达;而在高产细胞内,随着游离脂肪酸浓度的增加,其会解除FadR对相应启动子的阻遏作用,tetA基因正常表达.因此,在四环素存在的情况下,PopQC富集高产细胞并使之占据主导地位,最终游离脂肪酸的产量提高3倍(图2),相同的策略使得酪氨酸产量提高2.6倍.同样,Rugbjerg等人[101]利用胞内必需过程,
E.coli中设计了正向响应产物MVA的遗传回路以调控必需基因的表达.当MVA产量较高时,生物传感器与MVA结合从而激活必需基因的转录表达,导致菌株具有较高的生长速率;而当不存在MVA时,必需基因的表达也会被限制,从而导致较低的生长速率.因此在整个细胞群体中,生长缓慢的非生产细胞比例逐渐减少,具有高生长速率生产细胞逐渐占主导.最终,未改造的菌株在经过50次传代后MVA合成能力逐渐丧失,而引入产物成瘾系统的菌株在传代95次后仍然拥有高产能力,并且该系统无需使用抗生素并且不存在宿主受限的问题.研究人员还将产物柚皮素成瘾与负向自调控系统相结合,使得成瘾酵母细胞培养324代后仍拥有90.9%的柚皮素生产能力,而正常细胞在传代300代后丢失94.5%的生产能力,且恢复了正常生长[102].该策略同样适用于以E.coli为底盘细胞合成柚皮素的研究[103].
代谢异质性已成为影响细胞生产性能的主要问题,通过激励生产细胞和惩罚非生产细胞的方式可以用于对抗这种限制,从而通过富集生产细胞亚群稳定维持生产表型。
食品功能因子的可持续生物合成面临的一个主要挑战是扩大生产规模并维持高产性能.但是,异源基因表达引起的代谢负担会产生选择性压力,从而导致培养体系中非生产种群的自发形成,使得高生产能力但适应性较低的细胞丧失优势,最终导致整体生产性能下降.因此,将细胞生长与产物合成偶联可以很好地解决这类矛盾,从而提升细胞群体的生产性能.
相关新闻推荐
1、微生物生长动态监测系统oCelloScope——最强有力的病原菌诊断工具
3、水产养殖迟钝爱德华氏菌生长曲线及对链霉素敏感性检测(一)
