微生物合成食品功能因子方法、研究策略和进展(三)
4细胞生长与产物合成解偶联
产物的高效合成往往与底盘细胞生长竞争资源,在底物充足的条件下,对菌株生产力的最大限制来自用于支持细胞生长和内源性基础代谢所需资源的持续消耗.当导向目标代谢途径的资源不足时,大量的底物主要用于细胞的生长,从而导致生产能力下降.相反,过度的分流会影响细胞的生长从而降低生产强度.微生物底盘细胞的这种局限性可通过将细胞生长与产物合成解偶联来解决[104~106].将发酵过程解耦成生长和生产两个阶段进行动态调控,通过严格控制细胞的基础生长,在发酵早期最大程度地积累生物量,然后通过诱导激活合成途径将资源转向生产途径,这样细胞可在半衰老状态下工作,吸收利用底物进行产品合成。
4.1化合物诱导调控系统
特定化学物质和营养成分可以作为用于解偶细胞生长的诱导剂[107,108].IPTG和无水四环素是常用的诱导剂,已被用于1,4-丁二醇[109]、异丙醇[110]和苹果酸[111]等的生物合成调控.营养成分如甲硫氨酸被用于抑制PM ET3启动子驱动的基因表达以解偶细胞生长,提高青蒿素前体紫穗槐二烯的生物合成[112].Tan等人[113]在S.cerevisiae中利用四环素转录激活系统将碳通量转向产物合成,使得葡萄糖酸和异丁醇产量分别提高10倍和3倍.外源性诱导剂的动态调节是有效的,但需要精确控制诱导时间和诱导强度。
4.2群体感应系统
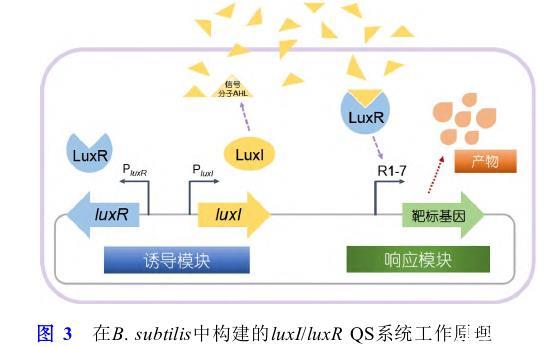
基于内源性压力感应机制,开发可自发调节的遗传回路以控制代谢是解偶细胞生长的另一种策略.群体感应(quorum sensing,QS)系统是一种响应细胞密度的基因回路,可以根据细胞密度自适应地将碳通量从生长转移到生产途径[114,115].目前研究最为广泛的群体感应系统主要是来自费氏弧菌的luxI/luxR系统[116]和来自玉米细菌性枯萎病菌的esaI/esaR系统[117].研究人员在E.coli中构建基于luxI/luxR的群体感应系统用于红没药烯的生物合成,其生产能力比需要添加诱导剂的工程菌株提高44%[118].天然QS回路虽然可以响应不同细胞密度进行动态调控,但是其动态调控的范围较为狭隘.因此,Ge等人[119]通过优化luxR-luxI基因间序列创建了一个具有高动态调控范围和低泄漏率的QS突变体库,将其应用于以E.coli作为底盘细胞合成4-羟基香豆素,其产量提高11.3倍.此外,该QS系统也广泛用于改善E.coli合成柚皮素[120]和中链脂肪酸[121]等.Corrêa等人[122]在B.subtilis中构建了基于luxI/luxR的群体感应系统自诱导基因回路(图3),并用于核黄素的生产.该系统包括两大模块,一个模块是包含2种变体的诱导模块——luxR和luxI基因以及各自的启动子,另一个模块是包含7种变体的应答模块——产物合成相关基因和控制基因表达的群体感应启动子.由LuxI合成的信号分子AHL扩散进入细胞,当AHL浓度达到一定阈值后与LuxR结合,从而激活应答模块中靶基因的表达.最终,最强响应元件S1-R6的转录水平是B.subtilis内源启动子Pv eg的3.2倍,筛选得到的工程菌株显示出响应细胞密度的核黄素生产曲线.然而,该群体感应系统只能正向响应信号分子的浓度,需要利用负调控元件才可进行双向调节,这会导致菌株代谢负担加重和灵敏性降低等问题。
与luxI/luxR不同的是,esaI/esaR系统中的信号分子受体EsaR具有同时产生激活和抑制的双重作用.在低细胞密度和信号分子AHL不存在时,EsaR可与启动子Pe saR的转录调控区结合抑制下游基因表达,也可与启动子Pe saS的转录调控区结合激活下游基因表达;而在高细胞密度和AHL浓度积累到一定阈值后,AHL与EsaR作用使其无法再结合到转录调控区,因此开启Pe saR启动子下游基因的表达和抑制Pe saS启动子下游基因的表达[117].Gupta等人[123]通过微调EsaI的表达,利用该系统控制1-磷酸果糖激酶和莽草酸激酶的表达,成功实现了细胞生长与产物合成途径碳通量的平衡,并有效提高E.coli中肌醇、葡萄糖二酸和莽草酸的产量。
由于真核生物的转录抑制需要染色质重塑,所以将这两类群体感应系统应用于S.cerevisiae仍具有挑战性.因此,已经设计了信息素群体感应系统用于改善羟基苯甲酸(para-hydroxybenzoic acid,PHBA)[124,125]、2′-岩藻糖基乳糖和3′-岩藻糖基乳糖[126]的合成.此外,研究人员还在B.subtilis中构建了基于Phr60-Rap60-Spo0A的双功能群体感应系统基因回路,通过解耦生长和合成将维生素K2产量提高40倍[127].群体感应系统的深入研究为动态调控代谢途径提供了新的指导,但仍有不足之处.基于群体感应的动态调控存在泄露表达,无法实现对目标基因的严谨调控,仍需对基因元件进行优化或挖掘更多的动态调控元件等.其次,由于群体感应系统的复杂性,其调控机制尚未完成解析明了,实现完全的宿主解偶联也仍需进一步研究。
近年来,利用基于代谢物响应转录因子的生物传感器来重编程细胞活性也已取得重大研究进展[128].通过将传感器——制动器与底盘细胞集成,以动态调控关键酶的表达并驱动碳通量转向目标途径.其中,丙二酰辅酶A是脂肪酸生物合成的前体,开发响应丙二酰辅酶A的生物传感器在克服限速途径和优化产量方面具有巨大的希望.FapR可以特异性响应丙二酰辅酶A的浓度并调节B.subtilis脂肪酸生物合成途径中相关基因的表达[129].Xu等人[130]设计响应丙二酰辅酶A的双启动子传感器动态调控胞内丙二酰辅酶A的通量以优化E.coli中脂肪酸的生物合成.在E.coli中,丙二酰辅酶A是通过accABCD基因编码的乙酰辅酶A羧化酶催化乙酰辅酶A合成,而低水平的丙二酰辅酶A使FapR处于活性状态,由p GAP启动子驱动的accABCD基因被激活,同时由T7启动子驱动的脂肪酸合成途径被抑制,从而使丙二酰辅酶A得以在胞内积累.随着细胞生长,丙二酰辅酶A积累到一定浓度时,开-关状态被转换从而开启脂肪酸的生物合成,使得细胞生长与产物合成解偶联.后通过优化FapR阻遏物结合位点fapO的数量,使得脂肪酸产量提高至3.86 g/L.另外也有研究通过设计分层遗传回路[106]和代谢转换开关[110]实现细胞生长与生产解偶联,从而提高目标产物的合成.细胞生长与产物合成解偶联可以通过严格控制非必需基因的基础表达,使得代谢负担最小化,从而在发酵早期阶段最大限度积累生物量.一旦达到一定的细胞密度时,便可将资源转移至产物合成途径从而实现高产.同时,生长与生产解偶联可以很好地避免有毒中间体的积累或对细胞有毒性的酶的过量表达,抑制合成毒性中间体的上游途径并在适当时间激活利用它的下游产物合成途径,从而更好地平衡细胞生长和产物合成。
5结论与展望

微生物细胞的生长调控在高效生物制造过程中有举足轻重的作用,构建优化模式微生物底盘细胞高效合成食品功能因子已取得一定的进展,几种功能性低聚糖、多种有机酸、氨基酸、维生素以及植物活性成分等均通过调控相应底盘细胞的生长实现产物有效合成(表2).快速有效地生长和高效地产物合成是微生物底盘细胞的两个重要特性,但由于细胞资源分配的局限性、异源途径与细胞代谢竞争导致的代谢通量失衡和代谢异质性等问题会严重影响微生物细胞工厂的生长特性,进而降低其合成性能.基于合成生物学原理和技术已开发出多种通过调控细胞生长改善生物合成的策略,通过碳源转运蛋白工程和适应性实验室进化提高底盘细胞的生长速率;通过调控NADH供给、F0F 1 ATP合酶的表达以及电子传递链以重编程细胞能量代谢;构建营养缺陷系统、开发基于群体质量控制和代谢产物成瘾系统使得细胞生长与产物合成偶联;构建化合物诱导调控系统和群体感应系统将细胞生长与产物合成解偶联,这些策略在优化细胞生长的同时可以有效增强产物的合成.而进一步提升细胞生长速率或挖掘具有更好生长潜能的新型微生物宿主,优化适应性进化方法以及完善动态调控工具将更好地促进高效合成食品功能因子细胞工厂的构建。
基于微生物的生长调控高效合成食品功能因子已取得重大进展,但仍然存在一些亟待解决的问题.目前已有多种策略可以有效提高底盘细胞的生长速率,但由于细胞自身的局限和代谢负担等问题,工程菌株的生长可能会仍低于野生型菌株,阻碍其工业应用.再者,目前研究对象主要局限于模式微生物底盘细胞,因此挖掘生长性能更优的微生物对实现产物的高效合成具有重大意义.随着新的微生物不断被发现,需要评估其生长代谢能力和产品合成效率.目前,一种快速生长的微生物——需钠弧菌(Vibrio natriegens)已被分离得到,其倍增时间小于10 min[131]并且相应的遗传操作工具[132~134]也已被开发,因此该菌株作为潜在的微生物合成平台具有远大前景,但该菌株作为合成食品功能因子细胞工厂的潜能仍需进一步验证,因为任何适用于食品合成的微生物底盘细胞的安全性最为重要。
动态调控可以有效减弱或避免传统代谢工程改造策略造成的细胞代谢负担、中间代谢物或有毒物质积累、辅因子失衡和细胞生长受损等问题.但目前开发的动态调控元件数量不多,且元件响应的灵敏性、正交性和稳定性仍需进一步优化.对此,可利用不同的调控元件构建逻辑线路,高效精细地调控代谢流;也可通过定向进化优化已有元件的响应性能,或者挖掘和开发新型调控元件.为了进一步扩展细胞生长调控方法的适用范围并且避免胞内代谢物干扰的问题,Liu团队[135]引入了基于密码子扩展的正交翻译系统,该系统可以实现在代谢流调控和细胞生长关键酶中插入非天然氨基酸(ncAA),并通过精确调控必需基因的表达来精准控制代谢流量和细胞生长.应用该策略,研究人员分别在基因组重编码的E.coli中将N-乙酰氨基葡萄糖产量提高了4.5倍,在基因组未重编码的B.subtilis中将燕窝酸产量提高了2.2倍,为创建生长与代谢精准可控的高版本底盘细胞提供了新策略.但该策略仍存在成本较高、难以大规模应用的问题,因此需要进一步优化.总之,基于系统生物学和合成生物学的代谢工程策略发展迅速,对微生物的各种机制进行深入挖掘,开发各种工具调控细胞生长,为实现食品功能因子的高效、绿色、稳定合成提供了潜力。
相关新闻推荐
1、Biosense微生物动态监测系统实验操作步骤——脓肿分枝杆菌的生长曲线
2、牦牛源短小芽孢杆菌生长曲线测定及药敏试验、体外抑菌结果解读(二)
3、金黄色葡萄球菌:红霉素、庆大霉素和氧氟沙星时间-抑菌生长曲线分析(一)
