不同包装方式下清蒸大黄鱼贮藏过程中PH值、菌落总数、菌群等的变化情况一览(三)
2.6包装方式对清蒸大黄鱼贮藏过程中菌落总数的影响
在0~24 d贮藏期间,普通包装、气调包装和真空包装清蒸大黄鱼菌落总数均呈增长趋势(表2),在24 d达到最高点,但均低于规定的限值(50 000 CFU/g),此时菌落总数最高的为普通包装组(19 000 CFU/g),其次为真空包装组(370 CFU/g),最后为气调包装组(120 CFU/g),与商业无菌标准相比,普通包装和真空包装组清蒸大黄鱼在6 d时已达到不可食用状态,气调包装组则在18 d时达到不可食用状态,表明气调包装能有效抑制清蒸大黄鱼中微生物的生长。

表2不同包装方式下清蒸大黄鱼4℃贮藏期间菌落总数的变化
2.7包装方式对清蒸大黄鱼贮藏前后微生物群落的影响
2.7.1包装方式对清蒸大黄鱼贮藏前后菌群多样性的影响
对清蒸大黄鱼进行生物信息学统计后,将种水平相似度为97%的序列划分OTU,由表3可知,贮藏后的清蒸大黄鱼OTU数有所下降。覆盖率在99.94%~99.96%之间,代表大部分样品序列被检测出,此次实验真实度较高,可以满足清蒸大黄鱼微生物多样性的分析要求。Chao 1指数和ACE指数代表清蒸大黄鱼菌群的丰富度,数值越大,所含的菌群种类越多。尽管对照组的菌落总数极低,但ACE指数与Chao 1指数的数值最高,物种最多,4℃气调包装和真空包装清蒸大黄鱼同样拥有较高的ACE指数和Chao 1指数。Shannon指数反映菌群的丰富度和均匀度,代表清蒸大黄鱼菌群的多样性,数值越高,多样性越高;Simpson指数则相反,数值越高,代表菌群物种越集中。对照组、4℃气调包装和真空包装清蒸大黄鱼的Shannon指数较高,而Simpson指数较低,说明这些样品不但维持着较高的菌群丰度,且不同物种菌群之间数量较为均衡。
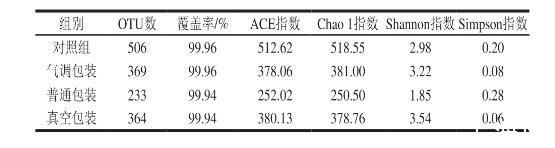
表3不同包装方式下清蒸大黄鱼细菌群落多样性指数
2.7.2包装方式对清蒸大黄鱼贮藏前后门水平群落结构的影响
如图5所示,从各组样品中检出1 0种主要菌门。对照组门水平上群落结构丰度前3的为变形菌门(Proteobacteria)、蓝细菌门(Cyanobacteria)和拟杆菌门(Bacteroidetes)。4℃下,3种包装方式样品门水平上群落结构相对丰度前3的门与对照组相似,但相对丰度有所不同,变形菌门相对丰度有所上升,蓝细菌门有所下降,尤其是普通包装组变形菌门相对丰度高达0.91,真空包装和气调包装组拟杆菌门相对丰度上升。值得注意的是,真空包装和气调包装组厚壁菌门(Firmicutes)相对丰度也有所上升,研究认为,变形菌门、拟杆菌门和厚壁菌门是具有致腐能力的常见菌门。
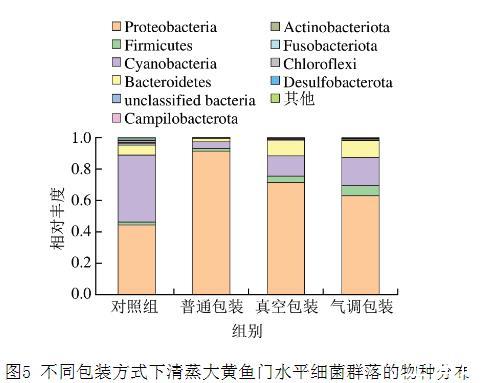
图5不同包装方式下清蒸大黄鱼门水平细菌群落的物种分布
2.7.3包装方式对清蒸大黄鱼贮藏前后属水平群落结构的影响
微生物的生长代谢是导致产品腐败变质的主要因素之一,但并非所有微生物都具有致腐能力,且不同物种致腐能力存在差异,腐败问题常归因于致腐能力较强的优势菌群,称为特定腐败菌(specific spoilage organism,SSO)。如图6所示,由对照组属水平上的群落结构可知,热处理未能完全杀死生肉、辅料及制作过程中带来的细菌,因此热处理过后,随着贮藏时间的延长,微生物会重新污染产品。
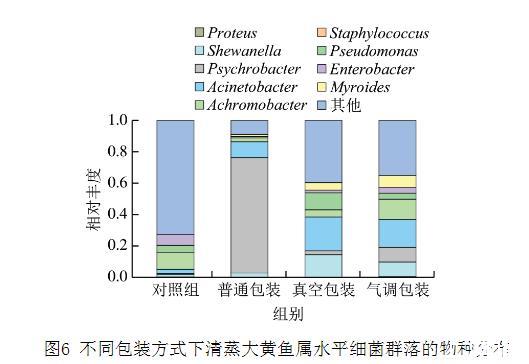
图6不同包装方式下清蒸大黄鱼属水平细菌群落的物种分布
4℃贮藏条件下,普通包装中最具优势的菌群为嗜冷杆菌(Psychrobacter),其次为不动杆菌(Acinetobacter);气调包装中相对丰度最高的是不动杆菌,其次是无色杆菌(Achromobacter),希瓦氏菌(Shewanella)和嗜冷杆菌的相对丰度也较高;真空包装下不动杆菌相对丰度最高,其次是希瓦氏菌和假单胞菌(Pseudomonas)。低温条件能降低微生物的生长速率,但是嗜冷菌依旧活跃,在嗜冷菌中,革兰氏阴性菌是重要的腐败微生物。4℃下相对丰度较高的菌种均属于嗜冷的革兰氏阴性菌,可以印证这一观点。希瓦氏菌和假单胞菌是大黄鱼低温贮藏条件下常见的SSO,有较强的致腐能力,能影响大黄鱼TVB-N含量、K值和生物胺等多项指标。嗜冷杆菌和不动杆菌能影响脂质的腐败进程,嗜冷杆菌还可以水解氨基酸产生异味,被认为是部分海产品的SSO,不动杆菌能够产生黏液和棕色色素,可能会降低产品的外观品质。无色杆菌能够对生物胺产生影响,故而具有一定致腐能力,但通常不是主要致腐菌。
2.7.4属水平物种丰度聚类热图
属水平上的物种丰度聚类热图可以更直观地反映细菌在属水平上的分布,也能更清晰地展现不同样品间菌群结构的差异。如图7所示,菌属颜色越接近红色,对应菌属在样品中的含量越高,菌属颜色越接近蓝色,则含量越低。经4℃贮藏24 d后,普通包装的清蒸大黄鱼中的优势菌属为嗜冷杆菌和不动杆菌,气调包装的清蒸大黄鱼中的优势菌属为不动杆菌与无色杆菌,而真空包装的清蒸大黄鱼中的优势菌属则为不动杆菌、希瓦氏菌和假单胞菌。结果表明,不同包装方式清蒸大黄鱼贮藏后菌群存在差异,而微生物扰动也是关键理化性质和风味物质发生变化的重要原因。
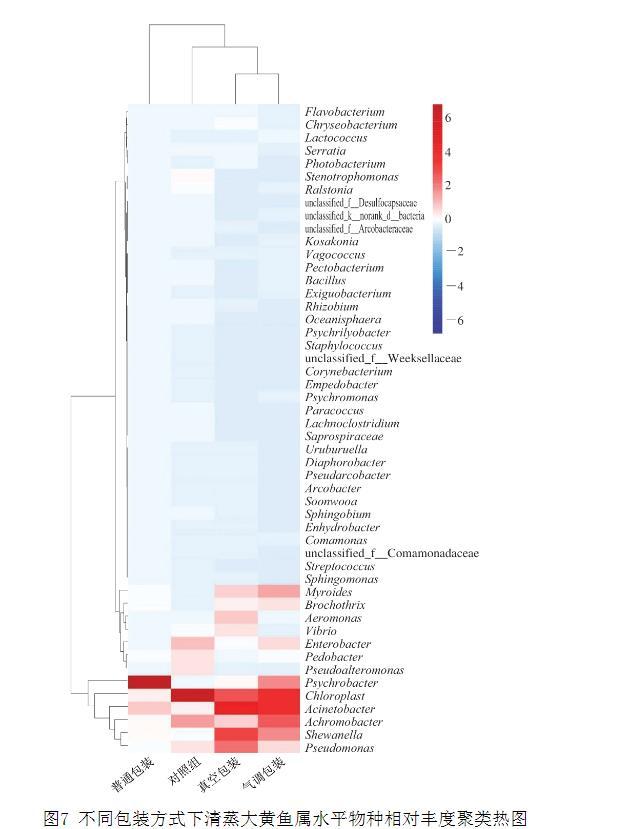
图7不同包装方式下清蒸大黄鱼属水平物种相对丰度聚类热图
2.8理化性质及关键挥发性成分与优势菌群相对丰度的相关性分析
对不同包装方式下贮藏的清蒸大黄鱼中的优势菌群相对丰度与理化因子及风味物质分别进行Pearson相关性分析,并绘制相关性热图。其中,相关系数>0表示正相关,相关系数<0表示负相关。由图8A可知,优势菌相对丰度与理化指标之间具有一定相关性,其中,无色杆菌相对丰度与pH值、TVB-N含量、TBARS值呈负相关;假单胞菌相对丰度与TBARS值也呈负相关;嗜冷杆菌相对丰度与TBARS值、TVB-N含量呈正相关;希瓦氏菌和不动杆菌相对丰度与汁液流失率呈正相关。由图8B可知,无色杆菌相对丰度与辛醛、己醛、癸醛、壬醛相对含量呈正相关;嗜冷杆菌相对丰度与辛醛、己醛相对含量呈负相关;假单胞菌相对丰度与庚醇相对含量呈负相关;希瓦氏菌相对丰度与庚醇相对含量呈负相关;不动杆菌相对丰度与庚醇、2-十一酮相对含量呈负相关。
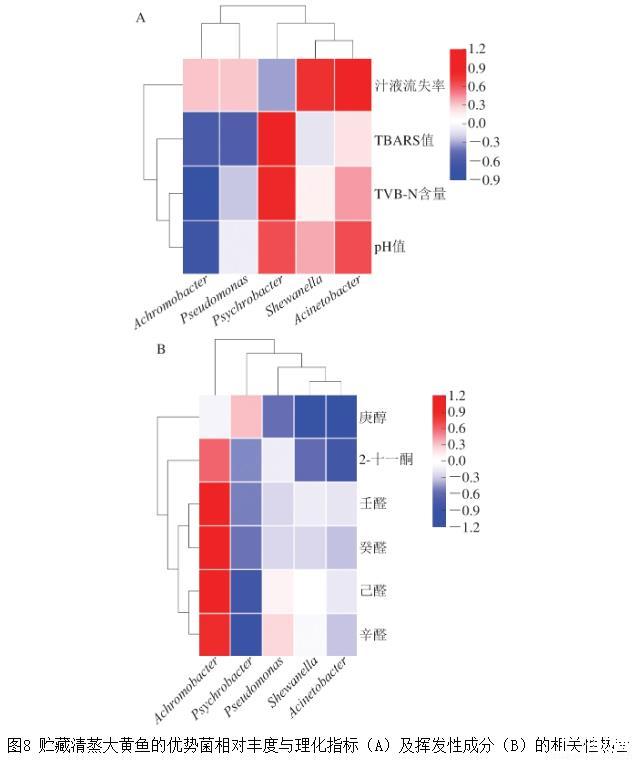
图8贮藏清蒸大黄鱼的优势菌相对丰度与理化指标(A)及挥发性成分(B)的相关性热图
3结论
本研究明确了不同包装方式下清蒸大黄鱼理化性质、挥发性成分和菌群的变化规律。
结果表明:4℃贮藏0~24 d,普通包装、气调包装、真空包装的清蒸大黄鱼TVB-N含量在可接受范围内;真空包装和气调包装均能有效抑制菌落总数和TVB-N含量的增长及脂质氧化,气调包装会使pH值降低,其中的CO2能更好地抑制微生物增殖;真空包装组TBARS值在贮藏24 d时仍未超出临界值;气调包装组菌落总数在18 d时才达到不可食用状态;清蒸大黄鱼关键挥发性成分为己醛、辛醛、壬醛、癸醛、庚醇、2-十一酮,气调包装的清蒸大黄鱼贮藏后风味优于普通包装和真空包装;贮藏后,清蒸大黄鱼的菌群多样性下降,4℃条件下,革兰氏阴性菌占据优势,普通包装、真空包装和气调包装组的优势菌门为变形菌门、蓝细菌门和拟杆菌门,普通包装的优势菌属为嗜冷杆菌和不动杆菌,气调包装为不动杆菌与无色杆菌,真空包装则为不动杆菌、希瓦氏菌属和假单胞菌。本研究可为清蒸大黄鱼贮藏条件、包装方式的选择提供理论依据,并为即食蒸制大黄鱼的工业化、标准化生产提供理论指导。
相关新闻推荐
1、根际溶磷菌对牧草品种扁穗雀麦生长促进作用的机理——材料和方法、结果与分析
