临床结核分枝杆菌体外药敏试验:分子DST检测VS表型DST药敏诊断技术(一)
摘要:目的比較结核分枝杆菌表型药敏与快速分子检测结果的一致性。方法回顾性分析2017年1月至2020年12月浙江省嘉兴市第一医院确诊的1750例涂阳肺结核患者痰液、肺泡灌洗液等标本,同时进行结核菌表型药敏及快速分子检测,对两种检测结果的一致性进行比较,并对不一致的原因进行分析。结果1750例患者按流程操作共检测得到结核分枝杆菌菌株1596例(91.20%),其中1542例利福平(RFP)两种方法检测结果一致(敏感1478例,耐药64例),一致率为96.62%;54例RFP不一致(3.38%)。1520例异烟肼(INH)两种方法检测结果一致(敏感1465例,耐药55例),一致率为95.24%;76例INH不一致(4.76%)。利福平(RFP)ropB基因突变位点分子检测检出率为94.79%(91/96),表型药敏检出率为93.02%(80/86)。异烟肼(INH)katG、inhA基因突变位点分子检测检出率为95.79%(91/95),表型药敏检出率为87.91%(80/91)。分析两种检测结果不一致的原因有检测标本不一致、检测技术局限性、不同突变类型、静默突变、异质性耐药及其他耐药机制。结论结核分枝杆菌表型药敏与分子检测结果的一致性高,差异无统计学意义,临床上扩大分子药敏作为初始诊断工具,可取得早诊治、早防控的效果;当检测结果不一致时,应及时分析原因,建议有条件的结核病定点医院使用两种检测方法平行检测以提高精准度。
结核病是由结核分枝杆菌(mycobacterium tuberculosis,M.tb)引起的呼吸道传染性疾病。耐多药结核病(multidrug-resistant tuberculosis,MDR-TB)的流行是结核发病率居高不下的重要原因,也是世界性的公共卫生问题。耐药结核病的诊断主要依靠体外药物敏感性试验(drug susceptibility testing,DST)。根据WHO指南,耐多药/利福平耐药结核病(rifampicin resistant tuberculosis,MDR/RR-TB)的发现首先需要细菌学确认,进一步行快速分子检测、痰培养或基因测序检测结核菌耐药情况。因此,正确判读快速分子检测与表型药敏检测结果,选择精准方案及疗程具有十分重要的意义。本研究收集2017年1月至2020年12月浙江省嘉兴市第一医院临床诊断为结核病患者的痰液、肺泡灌洗液等标本1750份,行快速分子检测表型药敏试验,现报道如下。
1材料与方法
1.1病例及菌株来源
入选病例菌株均来自2017年1月至2020年12月浙江省嘉兴市第一医院结核门诊及住院的涂阳肺结核患者痰液、肺泡灌洗液标本,行快速分子检测(Xpert MTB/RIF、基因芯片)及结核菌培养(罗氏固体培养及液体BACTEC MGIT960培养)并进行药敏试验,共计1750例。
1.2方法
1.2.1 Xpert MTB/RIF检测系统
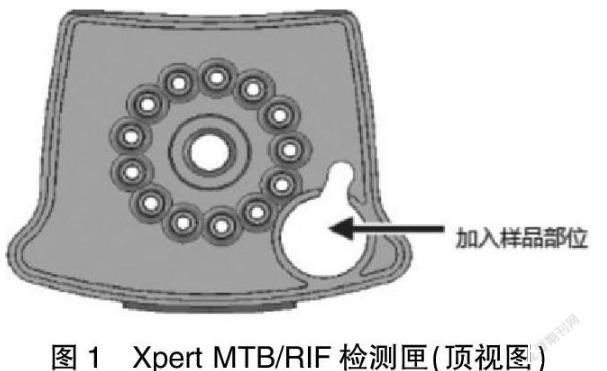
痰样本前处理。收集1~4 ml痰液样本置于一次性的防漏容器中,在Xpert MTB/RIF检测匣侧壁标记样本序号(ID)。打开装有痰液样本的容器,加入痰液样本2倍体积的样本试剂(sample reagent,SR)。盖上盖子,剧烈摇动10~20次或涡旋震荡至少10 s。将混合好的样本在20~30℃孵育15 min。在孵育进行到5~10 min时,再次剧烈摇动装有痰液样本的容器10~20次或涡旋震荡至少10 s。视样本性状,将1~2倍体积的4%氢氧化钠(NaOH)加入前处理管中,旋紧处理管的螺旋盖,在涡旋振荡器上振荡1 min左右直至痰样本充分液化,将前处理管置于生物安全柜内,室温静置15 min;将45 ml磷酸缓冲盐溶液(phosphoric acid buffer salt solution,PBS)加入液化好的痰液中,旋紧螺旋盖,将前处理管在3000 r/min离心20 min;去上清,加入2 ml PBS。将样品加入检测匣后,打开检测匣的盖子,将处理后的样品由检测匣的加样孔缓慢加入。见图1。关闭检测匣的盖子,开始检测,GeneXpert Dx软件自动读取信息进行自动检测。
1.2.2基因芯片检测系统
采用DNA微阵列芯片法进行菌种鉴定,使用博奥生物分枝杆菌菌种鉴定试剂盒,具体步骤如下。①从固体培养基上挑取菌落于含核酸提取液的核酸提取管中;液体培养基内吸取≥1个麦氏浊度的菌悬液10~20μl于含核酸提取液的核酸提取管中;使用Extractor 36核酸快速提取仪振荡5 min,95℃水浴5 min,5000 r/mim离心1 min,得到的核酸放置-20℃暂存。②在标本制备区内进行PCR扩增反应、芯片杂交、芯片的洗涤与干燥等步骤,甩干后扫描。③使用晶芯微阵列芯片扫描仪LuxScan10K-B和相应软件进行信号的读取及结果判读。阳性判断值:对于IC(分枝杆菌属)探针和结核分枝杆菌探针通过ROC方法确定其阳性判断值。对于其他16种非结核分枝杆菌检测探针均通过百分位数法确定其阳性判断值。当探针信号值大于或等于该探针的阳性判断值,则该探针判读为阳性;当探针信号值小于该探针的阳性判断值,则该探针判读为阴性。试剂盒中各探针的阳性判断值已整合到相应判读软件中,由软件自动对样品检测结果进行判别。
1.2.3临床结核分枝杆菌的培养及体外药敏试验
(1)结核分枝杆菌固体培养。①前处理方法:痰液中加2~4倍量2%NaOH,振荡器振荡5~10 min,或置室温30 min、其间振荡2~3次,使痰液化。取前处理液化后痰液0.1 ml,无菌操作接种于培养基斜面上,每份标本同时接种两支酸性改良罗氏培养基,置37℃孵育。对培养阳性的菌株进行分枝杆菌菌群鉴定,在试剂瓶中加入对硝基苯甲酸(PNB)和噻吩二羧酸肼(TCH)试剂,观察菌株生长指数,如继续生长为非结核分枝杆菌,如生长受到抑制则为结核分枝杆菌。②药物敏感性检测:选择4种常用的一线抗结核药物(异烟肼、利福平、链霉素、乙胺丁醇)进行体外药物敏感试验,抗结核药物浓度分别为异烟肼0.1 mg/L、利福平1.0 mg/L、链霉素1.0 mg/L、乙胺丁醇5.0 mg/L,采用WHO/国际防痨与肺部疾病联合会《耐药检测指南》推荐的比例法。
(2)结核分枝杆菌960液体培养。①培养管准备:MGIT营养添加剂(0.5%甘油,0.5%牛血清白蛋白,0.2%葡萄糖,140 mmol/L NaCl,OADC)为15 ml液体试剂,可直接使用,在每一根培养管中加入800μl MGIT营养添加剂备用。②样本准备:挑取1~2 ml脓性痰液部分至标记的50 ml离心试管中;加等量的2%N-乙酰半胱氨酸-氢氧化钠-枸橼酸钠前处理液;漩涡震荡20 s;静置15 min;加无菌PBS(pH=6.8)至约50 ml,盖紧盖子;离心3000 r/min,15 min;倒掉上清液;添加1~3 ml PBS以中和pH值至6.8。③样本接种:将上述预处理好的样本接种500μl至MGIT培养管中。④MGIT培養管装载至BACTECMGIT 960 System全自动分枝杆菌检测/药敏系统孵育培养。
1.3统计学方法
采用SPSS 13.0统计学软件进行数据处理,计数资料以[n(%)]表示,组间比较采用χ2检验(或Mc Nem),P<0.05为差异有统计学意义。通过Kappa检验分析两种方法一致性(Kappa>0.75,一致性较好;0.40~0.75,一致性一般;<0.40,一致性较差)。
相关新闻推荐
1、对虾养殖池水中叶绿素a浓度和微藻种类优势度指数及均匀度(下)
2、速生集胞藻6803光合放氧速率、生长曲线及基因组分析(一)
3、不同光照、pH条件对血红密孔菌培养过程中生物量、总抗氧化能力的影响(一)
