朱鹮细胞系的建立、体外生长特征、性染色体的荧光原位杂交鉴定(三)
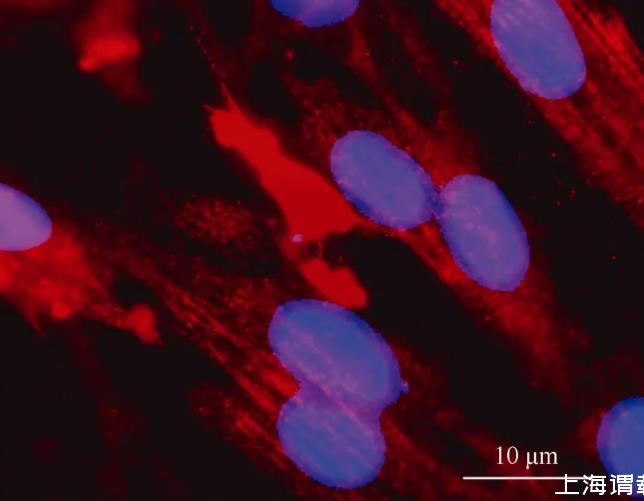
图2朱鹮细胞的平滑肌肌动蛋白抗体免疫荧光染色
2.2朱鹮细胞生长特性分析
利用MTT法,我们测定了连续培养7 d的不同传代数的朱鹮细胞生长情况。图3为5、10、20和25代朱鹮细胞的生长曲线。体外培养的朱鹮细胞表现出了典型的“潜伏期—对数生长期—停滞期”的生长模式。在细胞传代过程中,我们发现不同代数细胞的增殖能力和形成单层的时间有所不同。传代数<10的细胞,轮廓清晰、立体感强且增殖能力强,3 d即可形成致密单层;传代数>15的细胞,形成单层的时间逐渐延长,到20代以后,细胞增殖能力明显减慢,5 d才可形成单层;传代数>25的细胞,形态扁大,显现衰老特征且不能再形成单层。因此,我们所建立的朱鹮细胞系为有限细胞系,为保证细胞的旺盛生长力,需在建系早期多冻存传代数低的细胞,且要避免长时间连续传代细胞。
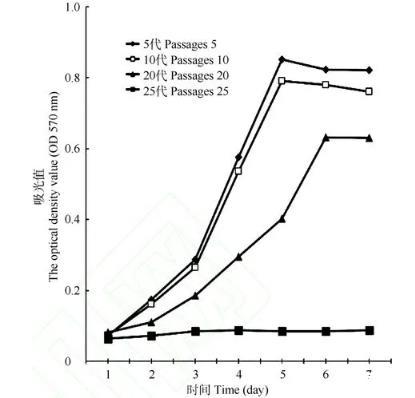
图3不同传代数的朱鹮细胞生长曲线
2.3细胞遗传学分析
为证实我们所建立的细胞系确实来源于朱鹮,排除培养过程中可能发生的细胞交叉污染,我们制备了这两株培养朱鹮细胞的中期染色体,并进行了以下细胞遗传学分析。
染色体数目和形态鸟类染色体所具有的大量微小染色体在使用Giemsa染液染色时着色较浅(图4A),在染色体分散不理想时不易计数。为了准确计数微小染色体,我们采用能使所有鸟类染色体均匀着色的荧光染料碘化丙啶(propidium iodine,PI,Amresco)对所制备的中期染色体进行染色(图4B)。对100个中期分裂相的计数结果表明,细胞的染色体众数为2n=68,包括性染色体在内有10对大染色体,其余为微小染色体。我们的结果与Liu et al(1992)报道的朱鹮核型分析结果一致,证明我们所建立的细胞系确实来源于朱鹮。
带型分析目前,有关朱鹮显带染色体未见报道。在本研究中,我们首次进行了朱鹮染色体Ag带、C带(图4C,D)和G带(图5)显示。在所观察的20个细胞中,银染的核仁组织者区(nucleolar organizer region,NOR)分布在一对微小染色体上(图4C,箭头所示)。C带(异染色质)主要分布在多数大染色体的着丝粒区域,微小染色体多为C带阳性,表明其微小染色体含有丰富的异染色质。W染色体和Z染色体的长臂末端均为C带阳性(图4D,箭头所示)。朱鹮的染色体C带与已报道的家鸡的染色体C带相似(Pollock&Fechheimer,1981)。图5为朱鹮的G带核型图,染色体排列方式参照Liu et al(1992)的报道,按染色体的相对长度,从长到短进行排列。G带分析结果表明,除雌性性染色体为异配的ZW以及雄性性染色体为同配的ZZ外,雌、雄个体的G带核型一致;Z染色体为中着丝粒染色体,相对长度仅次于第5号染色体;W染色体长度约为Z染色体的一半。这些结果与Liu et al(1992)的报道一致。虽然可以根据性染色体为同配或异配来鉴别鸟类的性别,但鸟类的W染色体较小,长度与一些较小的常染色体相当,因此,在常规染色的分裂相中,仅根据外形,很难准确鉴别W染色体(Shields,1982)。对于朱鹮W染色体的形态,Takasi&Sasaki(1974)的报道为亚端着丝粒染色体,Liu et al(1992)认为是中着丝粒染色体,而我们的G带核型分析支持其为亚端着丝粒染色体(图5)。

图4不同染色和显带的朱鹮染色体
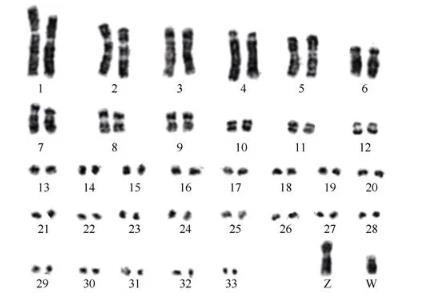
图5朱鹮的G带核型
朱鹮性染色体鉴别在以前的研究中,通过流式分选,我们已获得了石鸻(B.oedicnemus,鸻形目)的Z和W染色体特异探针(Nie et al,2009)。为准确鉴别朱鹮的性染色体,特别是W染色体,我们利用石鸻的Z和W染色体特异探针,分别与雄、雌性朱鹮的中期分裂相进行荧光原位杂交(图6A,B)。在雄性朱鹮的中期分裂相中,石鸻的Z染色体探针涂染了一对中着丝粒染色体(图6A),即Z染色体,与核型分析确定的Z染色体一致。在雌性朱鹮的中期分裂相中,石鸻的W染色体探针涂染了一条较小的亚端着丝粒染色体(图6B),直接证明W染色体是一条较小的亚端着丝粒染色体(图6C)。另外,石鸻的Z和W染色体探针分别在朱鹮的一对微小染色体和Z染色体长臂的末端有交叉杂交的信号。这种交叉杂交的信号,在以石鸻的Z和W染色体探针与家鸡的中期分裂相进行荧光原位杂交的实验中也曾被检测到(Nie et al,2009),表明石鸻的Z和W染色体探针中包含有与被杂交的染色体同源的序列,这些同源的序列可能是重复序列。
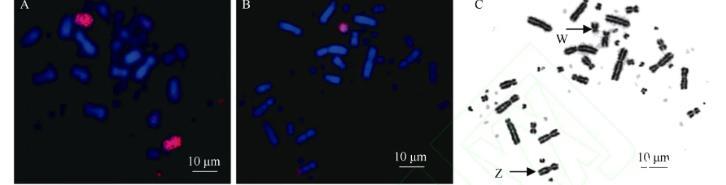
图6荧光原位杂交示例
近期,西安交通大学和华大基因已合作完成了朱鹮全基因组序列图谱绘制。朱鹮体细胞系的成功建立,不仅保存了这一珍稀濒危鸟类的遗传资源,也为后续开展其基因定位和其它生物学研究提供了实验材料。在本研究中所建立的朱鹮体细胞培养的方法,也可以用于其他鸟类的体细胞系建立和保藏。
相关新闻推荐
2、制药废水生化处理过程中硝化菌分离筛选、生长曲线的测定(二)
