pPopctrl质粒转化的大肠杆菌top10F生长与突变规律
基于群体感应的自杀基因回路能赋予宿主菌在一定密度时启动自杀的特性。在连续培养条件下可以形成菌群密度的周期振荡。这样的振荡作为基因组件,在合成生物学上有重要用途。美国杜克大学的You等建立起了自杀菌群模型并对其振荡规律进行了初步的研究,其建立的基因回路反映在质粒pPopctrl上,如图1所示。
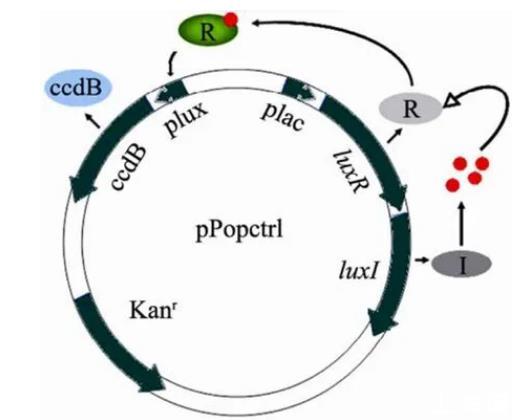
以pPopctrl质粒转化的大肠杆菌top10F’为研究对象,以不同浓度的IPTG诱导,观察宿主菌的生长和自杀特征以及在自杀过程中突变菌产生的规律,并通过基因测序确定变异位点。结果将为抑制突变个体产生,构建更具鲁棒性(Robustness)的自杀基因回路提供思路。
1材料与方法
1.1质粒、菌株和试剂
质粒pPopctrl由美国Duke大学Lingchong You博士惠赠。宿主大肠杆菌Top10F’菌株由本实验室保藏。按照上海捷瑞生物技术有限公司的一步法质粒转化试剂盒说明操作,构建工程菌(此菌株即为本文所说的野生型菌株wild type)。
试剂:胰蛋白胨购自美国BD公司;MOPS(Free acid 3-(N-吗啡啉)丙磺酸,BBI)、硫酸镁、氯化钠、IPTG、Kanamycin、LB培养基、LB琼脂培养基、矿物油、琼脂糖、溴化乙锭均购自上海生工生物工程有限公司。质粒小量提取试剂盒(离心柱型)购自上海捷瑞公司,质粒全测序和测序引物合成委托上海迈浦生物科技有限公司。
1.2细菌扩大培养
从甘油冻存管中刮取含有pPopctrl质粒的top10F’菌株,接种于LB(含50μg/mL的Kanamycin)培养基中,37℃、200 r/min振荡培养过夜,倍比稀释后涂布LB平板,37℃温育24 h,用接种环挑取单菌落接种于5 mL LB(含50μg/mL的Kanamycin)培养基中,37℃、200 r/min振荡培养15 h,作为实验接种液。
1.3细菌的生长特征监测和生长-自杀曲线的绘制
细菌的自杀实验在TBK培养基中进行。TBK培养基组成为:10 g/L胰蛋白胨(BD公司)、7 g/L氯化钾、20.93 g/L MOPS缓冲盐,用5 mol/L氢氧化钾溶液调节pH至6.0,灭菌后备用。将9μL接种液分别接种于9 mL TBK培养基(含50μg/mL的Kanamycin)中,培养基中IPTG浓度分别为0.01、0.05、0.08、0.1、1 mmol/L,并以不加IPTG的培养基作为对照。30℃、250 r/min振荡培养,间隔1.5~2 h取样200μL于96孔板中先后测定OD600和CFU,绘制生长-时间曲线。
OD600测定使用Perkin-Elmer Multi-label Plate Reader V3。
1.4突变菌株的筛选和鉴别
为了鉴别不同时间点样品中的野生型和突变型,利用二者生长曲线的不同加以区分。具体做法是:培养过程中不同时间点取样,倍比稀释涂布90 mm LB平板,培养后从中随机挑取30个单菌落,接种于96孔板中,每孔中加200μL TBK培养基,其中含Kanamycin和1 mmol/L IPTG,接种后每孔再加50μL矿物油封顶以防蒸发。预留2孔,其中TBK分别含或不含IPTG,此2孔接种野生型菌株分别作为阳性、阴性对照。将该96孔板置于Plate Reader V3中30℃孵育,每隔10 min振板30 s并测定OD600,连续测定18 h以上。绘制30个孔中30个单菌落的OD-时间生长曲线,与对照孔相比较,确定其中野生型和突变型的数量。
1.5突变菌株的质粒提取和测序
为了研究突变发生的位点,在不同时间点和不同IPTG浓度的菌液样品中随机挑选6株突变菌,LB扩大培养后用试剂盒抽提质粒,电泳检测后送上海迈浦生物技术有限公司测定质粒全长序列。测序结果用Vector NTI软件与pPopctrl质粒原始序列比对。
1.6突变质粒转化不含任何质粒的top10F’菌株后的生长曲线测定
为了研究是否质粒上的突变足以使宿主逃脱群体感应自杀行为,文中选择将2个已被证实的并已测序的突变质粒重新转化到不含任何质粒的野生型top10F’宿主菌中去,构建只有质粒突变的准野生型细菌,按照1.3中的方法测定CFU生长曲线。
2结果与分析
2.1不同IPTG条件下野生型的生长曲线和自杀强度
含有pPopctrl自杀质粒的top10F’细菌在含有不同浓度IPTG的培养基中的生长曲线如图2、3所示。从OD600曲线(图2)可见,IPTG的浓度对菌群密度有十分明显的影响,特别是在12 h以后,添加IPTG的样品管中浊度呈现显著差异。但是由于CcdB蛋白的细胞毒性体现在抑制了DNA复制,而细胞并不裂解,因此CFU曲线(图3)比OD600曲线更能准确地反映菌群的生长特征。从图3可以看出,6 h以前,各管细菌正常生长,而6 h以后,细菌开始大量自杀,CFU值迅速下降,在12 h前后降至最低值,而细菌的自杀率与IPTG浓度呈正相关。当IPTG浓度为1 mmol/L时,在短短6 h时间里,99.8%的细菌死亡,而IPTG浓度为0.05 mmol/L时,这一数值为98%,对于IPTG为0.01 mmol/L的样品管,其菌群密度一直低于对照管,但在整个实验周期内,观察不到明显的自杀现象。在12 h以后,菌群密度逐步缓慢回升,但在15 h后,由于营养条件的限制,菌群密度趋于稳定。
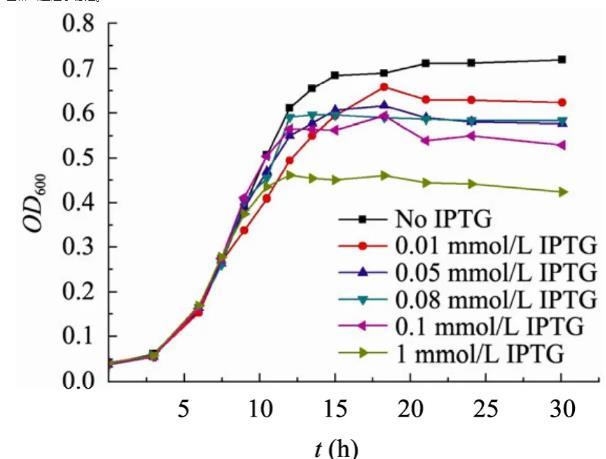
图2野生型细菌在不同IPTG浓度TBK培养基中的生长曲线(OD600曲线)
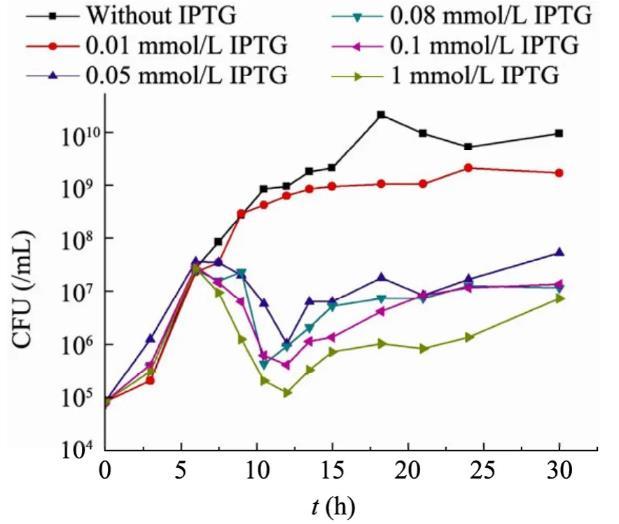
图3野生型细菌在不同IPTG浓度TBK培养基中的生长曲线(CFU曲线)
图3还显示细菌开始自杀的时间与IPTG浓度无关。在本文的实验条件下,群体感应发生作用或者说AHL分子达到阈值所需的菌群密度约为5×107个/mL。
上述现象可以根据自杀基因回路的设计原理得到合理的解释。IPTG浓度越大,lac启动子被诱导生成的R蛋白越多,AHL分子达到阈值后,被激活的R*也就越多,从而使lux启动子被更频繁地启动,大量的CcdB蛋白引起细菌自杀。而AHL浓度的累积仅仅与菌群密度有关,在其浓度达阈值前,所有样品管中的细菌生长速率相同,因此在同一时刻启动自杀。
2.2突变菌株的筛选和自杀过程中突变种群的蔓延
按照1.4中的方法,在每一个时间点取样涂布平板后随机挑选30个单菌落接种96孔板,绘制生长曲线并与阴性(Wild type,no IPTG)、阳性(Wild type with 1 mmol/L IPTG)对照比较。以0.1 mmol/L IPTG管13.5 h的样品为例,曲线如图4所示。
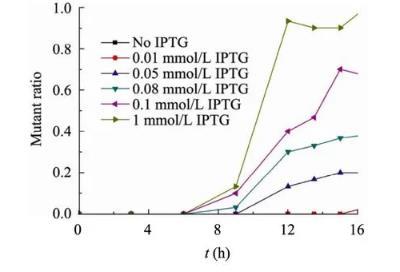
图5不同IPTG条件下突变型个体随时间产生和蔓延的趋势
随机挑选的30个单菌落中,有15个的生长曲线与阴性对照即不加IPTG的野生型一致,说明这些菌株不再被IPTG诱导自杀,属于突变型个体,因此确定在IPTG浓度0.1 mmol/L的样品管13.5 h的菌液中突变型比例为50%。
按照这一方法,我们研究了突变型个体随时间产生并逐渐蔓延的趋势(图4)。
从图3可知,6 h时细菌已经开始自杀;而通过图5可见,对于1、0.1、0.08 mmol/L IPTG的3个试管,突变型个体在9 h时才被筛选出来;而对于0.05 mmol/L的试管,则到12 h才有突变型出现。突变型个体的蔓延也与IPTG浓度密切相关。IPTG浓度越大,突变型个体蔓延得越快,伴随着野生型个体的大量自杀,突变型将迅速统治整个种群。
这一结果暗示:如果采用连续培养模式,利用6~9 h之间的窗口期,就有可能实现菌群密度的连续振荡而不被突变型个体所破坏。另一方面,如果将以IPTG浓度为参数的选择压力控制在一个合适水平,有可能实现野生型和突变型和平共存的稳态群落结构。
结论
本研究发现与细菌生死存亡相关的选择压力越大,亦即对细菌的杀伤力越大,突变型个体产生得越早蔓延得也越迅速。这方面的深入研究对总结杀菌型药物的给药剂量和频率有启示作用。
相关新闻推荐
2、10种有机物对氧化亚铁硫杆菌BYM磁小体生长、合成、发酵、产量的影响(二)
3、撒坝猪耳缘组织成纤维细胞系生长曲线、生物污染检测结果——结果与分析、讨论
