基于微生物生长曲线测定仪研发导管尖端的自动化培养鉴定方法
留置血管内导管是为患者实施诊疗时常用的医疗操作技术。随着各种导管在临床广泛的应用,导管相关的感染也越来越多。血管导管相关感染(Vessel CatheterAssociated Infection,简称VCAI)是指留置血管导管期间及拔除血管导管后48小时内发生的原发性、且与其他部位感染无关的感染,包括血管导管相关局部感染和血流感染。目前临床常用的导管的类型包括中心静脉导管、PICC、脐血管导管、完全植入式静脉输液港、血液透析导管、外周动脉导管、漂浮式肺动脉导管等。这些导管的植入是一种侵袭性操作,操作过程中污染,护理不当,放置的时间过长、菌血症等原因都会引起导管相关感染。
据报道,聚氯乙烯、硅胶制品等导管可以粘附大量微生物,从而增加感染几率。随着导管留置时间延长,导管在其内的留置会使血液中的纤维蛋白及血清蛋白沉淀聚集在导管表面,反而起到了保护病原体的作用。综上,病原体可沿导管表面向体内蔓延生长,繁殖到一定数量时释放人血就会出现菌血症、败血症的相关临床症状,有感染导致休克死亡的风险。因此,及时确定是否血管导管相关感染并快速选择合理有效的抗感染药物是治疗成功的关键。
为明确导管相关感染,需要进行导管尖端培养以明确诊断,鉴别致病菌。目前常见的检测方法包括以下步骤:1)用无菌剪刀剪下导管尖端,2)将剪下的导管尖端放在无菌容器中送至专业微生物检验实验室,3)在实验室内将待测导管尖端在血平皿上作滚动涂布接种,4)将血平皿在恒温培养箱中培养约20h,5)取出血平皿通过观察有无菌斑来判断该导管尖端外部是否被可培养细菌污染。如果需要检测导管尖端内部是否被污染,则需要采用超声震荡无菌生理盐水冲洗导管尖端,然后将冲洗水涂在血平皿上接种,再进行其它的操作步骤。目前检测导管及导管尖端是否被病原体污染的主要问题有四个,一是即使有细菌粘附污染,在接种时也不一定能(全部)从待测导管尖端上脱离并接种到血平皿上,因而易造成假阴性误判;二是操作繁琐,结果严重依赖微生物检验专业操作人员的个人技能;三是周期长,效率低,培养结果在72小时后才能反馈给临床;这导致针对致病菌的针对性治疗延后了至少72小时。四是致病原鉴定无法在床旁等现场实施。
目前医疗行业急需简便高效、快速准确检测导管相关感染及床旁快速药敏试验的新技术。
导管尖端的自动化培养鉴定步骤:
步骤1:一次性检测管中预装入蛋白胨水,将待测导管尖加入到所述一次性检测管中,将一次性检测管封口;
步骤2:然后将一次性检测管插入微生物生长曲线自动化测定仪器中的检测通道;
步骤3:通过微生物生长曲线自动化测定仪器测定的细菌生长曲线形状判断目标导管尖是否有细菌或真菌定植
采用八通道电容耦合非接触式电导率检测器作为传感单元,采用一对同轴铜气缸作为致动器电极和拾取电极,构成电容耦合的非接触式电导率检测器的工作通道。在将充满含有导管尖的培养液试管插入工作通道后,将交流电压施加到致动器电极上,以电容耦合到水介质中。致动器电极和拾取电极与绝缘管和介质形成两个耦合电容(Cw)。损耗电容(Cs)产生于两个电极通过空气(Cs)之间的直接电容耦合。该水介质相当于一个电阻器接收站。介质的表观电导率(直流电压信号)在拾取电极上获得;其大小与水介质中离子载流子的浓度和迁移率成正比。如果导管尖存在细菌或者真菌,细菌或真菌细胞将在所需的温度下增殖和生长。细菌的生长转化了不带电或弱带电的底物,酵母、肽和糖转化成高电荷的最终产物,如氨基酸、醛、酮、酸等代谢物,提高水介质的电导率。通过电容耦合的非接触式电导率检测器,每间隔30秒自动在线收集水介质的表观电导率。由于电导率的变化而不是绝对值与细菌生长的动力学过程成正比,我们使用算法计算每个试管中水介质的电导率变化值(即归一化表观电导率值NACV)如下:
NACVn=ACVn-ACV0
式中,NACVn为n点收集的实时NACV;ACVn为n点收集的表观电导率值;ACV0为孵育开始时收集的初始表观电导率值。然后通过绘制NACVs为孵育时间的函数来生成s型CCS生长曲线。当导管尖没有任何细菌真菌时,生长曲线为一条直线(没有s型CCS生长曲线)。
细菌或者真菌在生长代谢的过程将分解导电性较差的有机大分子物质,生成导电性较好的小分子物质和离子,造成混合体系导电能力的增加,即混合体系电导C值的增加。这种电导的增加过程可以通过电子微生物生长分析仪实时在线监测并生成C-t曲线。从电子微生物生长分析仪自动报告的细菌生长C-t曲线形状直接读出定性检测结果:正峰,且电导率值(NACV)>0.02V,说明目标细菌或菌群生长;水平线,说明细菌没有生长。
快速药敏试验为头孢他啶管和头孢他啶-克拉维酸管在培养45000s内,两管电导率值差值(NACV’)>0.02V。
导管尖端的自动化培养鉴定方法工作过程为:
将从临床送检的导管尖端放置到预先装满蛋白胨水的专用检测管中,将检测管封口后插入电子微生物生长分析仪,电子微生物生长分析仪全自动在线监测并绘制出非接触电导(C)-时间(t)曲线。从电子微生物生长分析仪自动报告的细菌生长曲线形状直接读出结果(培养45000s内):电导率值(NACV)>0.02V,说明导管尖存在细菌或真菌;电导率值(NACV)<0.02V或水平线,说明没有细菌或真菌生长。细菌的生长代谢过程由电子微生物生长分析仪全自动在线监测并绘制出非接触电导(C)-时间(t)曲线。测定结束后根据C-t曲线的形状及电导率值判断导管尖是否有细菌生长。
测定金黄色葡萄球菌(ATCC25923)标准菌株在导管尖内定植能否被检测。
步骤一、启动电子微生物生长分析仪(ER832型,澳大利亚eDAQ公司产品)和专用计算机。在检测软件窗口设置温度、采集频率、采集次数、激励频率和激励强度参数分别为38℃、1分钟/次、1200次、30KHz和80%,预热10分钟,待用。
步骤二、采用单通道移液器(大龙公司产品,量程为0-200μL)将含107
CFU/mL金黄色葡萄球菌(ATCC25923)的200μL LB液体培养基打入导管尖中,将导管尖放入已经预装有2mL蛋白胨水(广州迪景微生物科技有限公司)的一次性检测管(青岛谷峰实验仪器有限公司产品,U型,材质为聚丙烯,外径5mm,内径4.5mm,管长170mm),然后采用无菌胶塞封住管口。同样,将200μL无菌LB液体培养基打入导管尖中,将导管尖放入已经预装有2mL蛋白胨水的一次性检测管并封口,作为阴性对照;
步骤三、将上述两个检测管分别插入电子微生物生长分析仪的检测通道,并开始测定细菌C-t曲线。
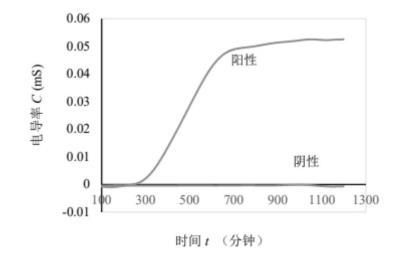
步骤四、对应于待测金黄色葡萄球菌(ATCC25923)和阴性对照的C-t曲线如图1所示。其中阴性对应一条直线,说明检测体系未被污染。金黄色葡萄球菌(ATCC25923)对应一条正峰(即细菌生长代谢且结果造成血液电导增加),说明体系中细菌能够正常生长代谢。
测定肺炎克雷伯菌(ATCC700603)标准菌株快速药敏试验。
步骤一、同实施例1步骤一。
步骤二、采用单通道移液器将含肺炎克雷伯菌(ATCC700603)待测菌株107
CFU/mL200uL打入两个导管尖中,将含有待测菌株的导管尖所在的蛋白胨水作为待测液分别加入已经预装含有头孢他啶(16mg/L)、头孢他啶-克拉维酸(16/4mg/L)的蛋白胨水中的一次性检测管,然后采用无菌胶塞封住管口。同样,将200μL超纯水转入一个同样已经预装有蛋白胨水的检测管并封口,作为阴性对照;头孢他啶-克拉维酸管与头孢他啶管比较,可初步判断是否产超广谱内酰胺酶。
步骤三、将上述三个检测管分别插入电子微生物生长分析仪的一个检测通道,并开始测定细菌C-t曲线。
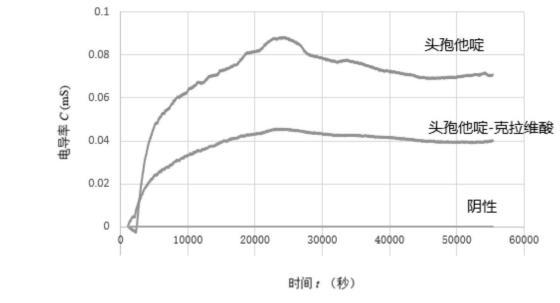
步骤四、对应阴性对照、含有头孢他啶(16mg/L)、头孢他啶-克拉维酸(16/4mg/L)的蛋白胨水的C-t曲线如图2所示。其中阴性对应一条直线,说明检测体系未被污染。含有头孢他啶(16mg/L)比头孢他啶-克拉维酸(16/4mg/L)在培养45000s内,两管电导率值差值(NACV’)>0.02V。说明体系中细菌能够正常生长代谢且产生超广谱β内酰胺酶(即具有耐药性)。通过是否产生超广谱β内酰胺酶判断细菌是否具有耐药性。
超广谱β内酰胺酶(ESBL)是一类能水解青霉素类,头孢菌素类以及单环类抗生素的β-内胺酶,其活性能被某些B-内酷胺酶抑制剂抑制。能产生ESBL的细菌即为ESBL(+)菌,可对上述多种抗生素产生耐药;
肺炎克雷伯菌为一种革兰氏阴性杆菌,其最重要的耐药机制是产生超广谱β-内酰胺酶;
头孢他啶-克拉维酸(头孢他啶与克拉维酸联用)的原因:革兰氏阴性杆菌产生的超广谱β内酰胺酶的活性可以被β内酰胺酶抑制剂,比如克拉维酸所抑制。
