肠道菌群在帕金森病中的可能发病机制、防治现状(一)
摘要
帕金森病是一种常见的神经退行性疾病,严重威胁着中老年人的健康,然而目前帕金森病的发病机制尚不完全明确。近年的研究显示,肠道菌群在帕金森病的发生发展中发挥重要角色,肠道菌群及其代谢物通过微生物-肠-脑轴影响机体的肠道黏膜屏障、神经炎症、内分泌等方面进而参与到帕金森病的发生发展中。肠道菌群可通过补充益生菌、粪菌移植、饮食调整、中医药干预等多种途径进行调控,是帕金森病防治的重要靶点。本文对肠道菌群在帕金森病中的可能发病机制进行综述,并进一步探讨肠道菌群失调的防治现状。
帕金森病(Parkinson’s disease,PD)是仅次于阿尔茨海默病的第二常见的神经退行性疾病,多发于65岁及以上人群,与衰老密切相关,流行病学研究数据表明我国此类人群的患病率达1.6%[1]。随着我国人口老龄化进程的加速,PD患者数量急剧增加,这将会带来严重的经济和医疗负担。PD的主要病理特征为α-突触核蛋白(α-synuclein,α-syn)的异常聚集以及中脑黑质多巴胺能神经元的丧失,以运动症状和非运动症状为主要特征,严重影响患者的生活质量;PD运动症状包括运动迟缓、僵硬、异常姿势和静息性震颤等;患者还经常出现非运动症状,如便秘、焦虑、睡眠障碍、自主神经障碍等[2]。研究发现,大多数的PD患者存在胃肠道症状,如恶心、便秘、胃排空延迟等,其中约80%的PD患者会出现便秘,而且便秘症状比PD运动症状平均早10年或者更久[3]。近年来越来越多的研究表明,肠道菌群与PD密切相关,因此明确肠道菌群在PD中的作用机制,可能为PD的干预与治疗提供新思路。
1肠道菌群与PD的相关性
1.1微生物-肠-脑轴
微生物-肠-脑轴(microbiome-gut-brain axis,MGBA)是将大脑与肠道功能整合的双向信息交流系统,其中微生物在系统中扮演重要角色。肠道微生物通过神经系统、免疫系统和神经递质等途径与大脑进行交流[4-5]。肠道微生物可以直接刺激肠神经(enteric nervous system,ENS)传入神经元,通过迷走神经(vagus nerve,VN)对脑发出信号。肠道微生物还可以通过免疫反应影响机体炎性因子水平进而影响中枢神经系统的功能。此外,肠道微生物能合成多巴胺(dopamine,DA)、5-羟色胺(5-hydroxytryptamine,5-HT)、γ-氨基丁酸(γ-aminobutyric acid,GABA)等多种神经递质,通过ENS直接或间接地将信号发送给大脑。
1.2 PD患者和动物模型肠道菌群组成的变化
Mao等研究发现,PD患者粪便样本中普雷沃氏菌属(Prevotella)的丰度降低,与疾病严重程度呈负相关关系[6]。此外,Nishiwaki等研究表明,PD患者肠道菌群内分解肠道黏蛋白的阿克曼氏菌属(Akkermansia)丰度升高,而产生短链脂肪酸的罗斯拜瑞氏菌属(Roseburia)和栖粪杆菌属(Faecalibacterium)丰度下降[7]。
在PD动物模型中同样也存在着肠道菌群组成的改变。Gan等[8]对1-甲基-4-苯基-1,2,3,6-四氢吡啶(1-methyl-4-phe⁃nyl-1,2,3,6-tetrahydropyridine,MPTP)诱导的PD小鼠粪便研究显示,厚壁菌门(Firmicutes)和疣微菌门(Verrucomicrobia)丰度增加,而拟杆菌门(Bacteroidetes)丰度降低。王玉等[9]研究发现,PD小鼠粪便中出现菌群失调,菌群多样性升高且菌群组成发生明显变化,厚壁菌门/拟杆菌门的比值增加,而且变形菌门(Proteobacteria)和放线菌门(Actinobacteria)丰度升高。此外,Zhao等研究发现,鱼藤酮诱导的PD小鼠粪便中脱硫弧菌属(Desulfovibrio)和阿克曼氏菌属的相对丰度显著增加[10]。更多关于PD患者和动物模型肠道菌群组成变化的研究总结见表1。以上结果表明,PD患者及PD动物模型的肠道菌群与健康的肠道菌群相比,在组成上存在明显差异,而且菌群变化与PD的发病密切相关。
1.3肠道菌群与α-syn聚集
聚集性α-syn是神经元包涵体即路易小体(lewy bodies,LBs)和路易神经突(lewy neurites,LNs)的主要成分,是PD的病理标志[16]。α-syn的聚集可能始于肠道,经过迷走神经进入大脑,肠道菌群的改变是导致α-syn聚集的潜在因素。
在动物模型中,对过度表达α-syn的小鼠研究发现,具有正常肠道微生物菌群的小鼠脑内出现α-syn的异常聚集,而无菌小鼠并未出现以上改变;此外,将健康人群和PD患者的肠道微生物群分别移植到过表达α-syn的无菌小鼠肠道中,结果显示,接受PD患者肠道微生物群移植的小鼠出现明显的运动功能障碍,这表明PD患者肠道微生物的存在加剧了肠道中α-syn的病理变化[18]。以上研究表明,肠道菌群在α-syn的聚集中发挥重要作用。
2肠道菌群代谢产物与PD
2.1短链脂肪酸(short chain fatty acids,SCFAs)
SCFAs是肠道菌群的重要代谢产物之一,它的含量可以间接反映PD患者肠道菌群组成的变化。PD患者经常表现出胃肠功能障碍,而SCFAs可以调节肠神经系统活性,促进胃肠运动;与健康对照组相比,PD患者粪便中SCFAs含量以及产生SCFAs的细菌数量明显减少,因此SCFAs浓度的改变可能是引起胃肠功能障碍的原因[19]。一项临床研究表明,PD患者的低SCFAs与较差的认知能力和低身体质量指数(body mass index,BMI)显著相关,较低的丁酸水平与较差的姿势不稳定-步态障碍评分相关[20]。在鱼藤酮诱导的PD小鼠中,丁酸钠(sodium butyrate,NaB)的干预减少了多巴胺能神经元的丢失及α-syn的聚集,通过重塑肠道菌群的组成改善小鼠肠道功能障碍[21]。
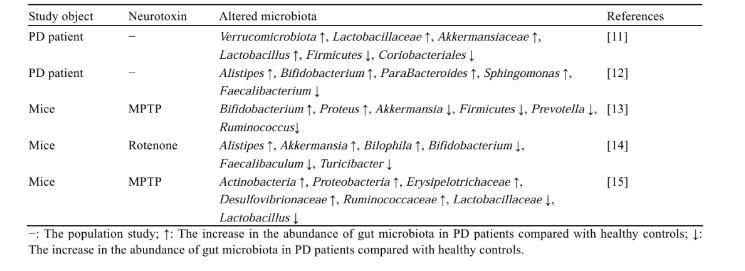
表1 PD患者和动物模型肠道菌群组成的变化
2.2胆汁酸(bile acids,BAs)
近年来,BAs成为微生物-肠-脑轴研究中的“明星分子”,它被证明是一种抗炎分子,在PD和阿尔茨海默病等神经退行性疾病中展现出治疗潜力[22]。Nie等研究表明,伴有认知障碍的PD患者血清BAs有明显改变,表现为鹅去氧胆酸(chenodeoxycholic acid,CDCA)、胆酸(cholic acid,CA)和熊脱氧胆酸(ursodeoxycholic acid,UDCA)水平的降低[23];在PD小鼠模型的血清中,牛磺熊脱氧胆酸(tauroursodeoxycholic acid,TUDCA)水平与对照组相比均显著降低[24]。
2.3脂多糖(lipopolysaccharides,LPS)
LPS又称为内毒素,是革兰氏阴性菌外膜的主要成分,由脂质和多糖构成,被公认为是一种促炎因子,也可用来诱导PD动物模型。肠道菌群紊乱导致LPS增加,而LPS能够特异性识别并结合Toll样受体4(Toll-like receptor 4,TLR4),释放促炎细胞因子引起全身炎症[25]。Gorecki等研究表明,PD患者粪便中产生LPS的革兰氏阴性菌γ-变形菌纲(Gammaproteobacteria)的丰度明显高于健康对照组[26]。Yan等[12]研究发现,PD患者肠道中革兰氏阴性菌与革兰氏阳性菌的比值升高。
2.4氧化三甲胺(trimethylamine oxide,TMAO)
TMAO主要是通过肠道内的厚壁菌门和变形菌门等微生物对富含胆碱、甜菜碱、肉碱的食物进行代谢产生,它可以穿过血脑屏障,与神经炎症密切相关[27]。临床研究表明,PD患者血浆中TMAO水平明显下降,这种较低水平的TMAO可作为PD早期诊断的生物标志物[28];另一项研究则发现,PD患者血浆中TMAO水平升高,并与疾病的严重程度和运动症状进展呈显著正相关[29]。以上临床研究结果表明,TMAO与PD之间存在较强的相关性,但具体结论并不一致。
综上所述,肠道菌群代谢产物的含量变化与PD存在密切的相关性,它们通过调节肠道功能、影响神经炎症、参与神经保护机制等方式参与到PD的进程中。因此,调节肠道菌群结构影响其代谢产物可能成为防治PD的新策略。
相关新闻推荐
1、土霉素菌渣无害化处理:筛选菌株的生长曲线及产蛋白酶条件(一)
2、不同条件下裂片石莼水培液的组成成分对耐药弧菌株的抑菌作用(三)
3、三种抗菌药物处理后持留菌株和抗药菌株生长曲线、优势的比较——结果与分析、讨论与结论
