鲫鱼戴氏西地西菌生长曲线绘制及药敏试验结果(二)
1.3.2.3药物敏感试验
用丹麦Biosense微生物生长监测系统仪器进行鉴定,鉴定板为革兰阴性菌药敏板,100孔,试验周期15 h结束后观察结果并分析。
1.3.2.4生长曲线的测定
取-80℃保存的菌株,在超净工作台内取100μL菌液,加入到液体LB试管中,30℃,150 r/min,培养24 h后同样方法进行传代至第3代。取第三代菌液100μL,加入盛有100 mL液体LB的锥形瓶中,30℃,150 r/min条件下震荡培养。设此时间为0 h,调分光光度计波长λ=600 nm。分别测定0、2、3、4、5、6、8、10、12h和16、18、20、24 h各时段所对应的OD值。每个时段测定3个平行试样[6]。
1.3.2.5回归试验
试验鱼选用当年的鲫鱼,购自吉林省金龙渔场。驯化7 d,选取体格健壮、规格整齐、游动活跃平均初体重为(98±0.01)g的鲫鱼120尾,随机分为4组,1组对照组,其余3组为试验组。将4组鱼同时放入相同水环境不同鱼缸中(鱼缸规格80 cm×60 cm×100 cm)。对照组每条鱼注射无菌液体LB培养基0.5 mL,试验组每条鱼注射30℃,培养6 h的含致病菌的液体LB 0.5 mL。27℃水温下饲养7 d,观察,并记录[7-8]。从死亡的病灶部位进行病原菌的再分离及鉴定。
2试验结果
2.1革兰染色结果
显微镜下可以观察到红色,短杆状,呈单双排列。结果表明该菌为革兰阴性菌。从鲫鱼鳃部、肝、胰脏和肾脏等部位分离的菌株具有相同特征。
2.2生化鉴定结果
该菌与乙酸、Beta-葡二糖和葡萄糖等16项生化指标反应呈阳性,表明该菌能发酵或利用这些物质;而与黏菌素、七叶苷和山梨醇等29项生化指标反应呈阴性。综上所述,该菌鉴定为戴氏西地西菌,鉴定可信度为99%。
2.3药物敏感试验结果
结果如表1可知该菌对亚胺培南、美洛培南和环丙沙星等高度敏感;对氨曲南和头孢唑啉耐药性最强。
表1药敏试验
2.4生长曲线的测定结果
根据0、2、3、4、5、6、8、10、12、16、18、20、24 h所测的菌液的OD值结果,取每组的平均值,绘制菌株OD值随时间变化的关系图(如图1)。可看出该菌株2~6 h进入对数期,对数期时间较早,22 h后就进入了稳定期。
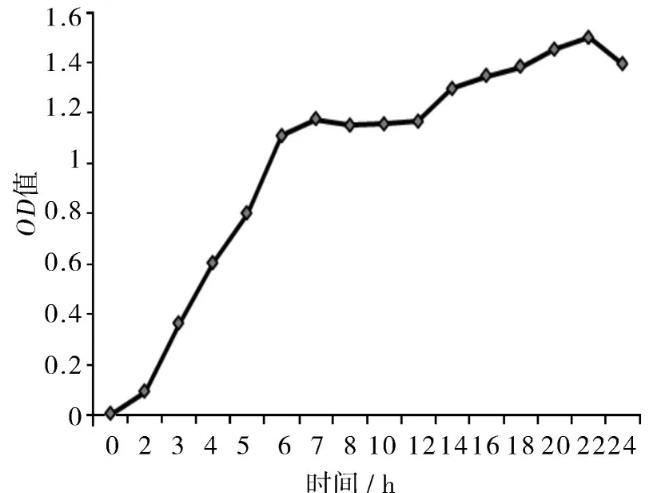
图1菌株OD值随时间变化的关系
2.5回归试验结果
攻毒32 h后,鲫鱼精神委顿,很少游动,减食或不食,48 h后出现死亡现象。试验结束后,试验组鱼均出现不同数量的死亡,但对照组没有任何死亡现象,结果如表2。死亡鲫鱼主要症状为胸鳍和腹鳍基部及生殖口均出现充血现象。鱼身出现不同的出血点及溃烂。剖检死鱼,鳃部发红有的鳃丝发白,肠道、肝、胰、脾脏等处均出现充血症状。与之前的病鱼完全吻合。根据上述革兰染色反应及生理生化检验,得到细菌的特征与上述分离的温和气单胞菌的特征完全相符
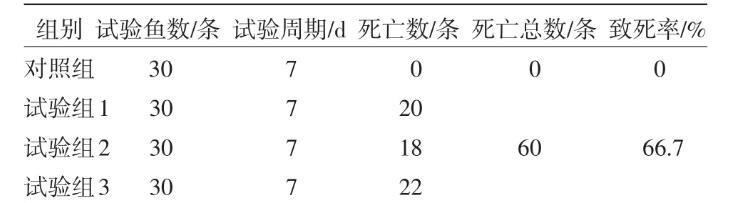
表2回归试验
3讨论
本试验首次从发病鲫鱼分离出戴氏西地西菌,该菌使鲫鱼胸鳍和腹鳍基部及生殖口均出现充血现象。鱼身出现不同的出血点及溃烂。剖检死鱼,鳃部发红有的鳃丝发白,肠道、肝、胰、脾脏等处均出现充血症状。革兰染色结果为红色,是革兰阴性菌,短杆状大小为0.5~0.6μm×1~2μm。生化鉴定结果可知该菌与乙酸、Beta-葡二糖、L-色氨酸-AMC和葡萄糖等反应呈阳性,表明该菌能发酵或利用这些物质;而与黏菌素、七叶苷、山梨醇和L-阿拉伯糖反应呈阴性。回归试验结果发现其死亡率达66.7%,对鱼类危害严重。本文对其进行了药敏试验,发现其对亚胺培南、美洛培南、左氧氟沙星和环丙沙星等高度敏;感,对氨曲南和头孢唑啉耐药性最强。与朱红楠等[9]2002年在临床检验杂志发表的痰液中检出戴氏西地西菌1例的药敏结果相符合。
本试验致病菌最终鉴定为戴氏西地西菌。本文制作了它的生长曲线,为其后面的研究打下了基础。并利用用全自动微生物分析仪进行药敏分析,结果分离出几种高度敏感的药物,为减少该菌对鲫鱼造成的危害提供实践和理论基础。因鲫鱼感染戴氏西地西菌的发病机理及各方面的理论都不成熟,所以还需要进行进一步的探索。
相关新闻推荐
3、利用CIRBP作为胰腺癌诊断及治疗分子标记物(细胞增殖生长曲线检测步骤)
