多抗噬菌体菌株大肠杆菌E.coli PRE12在LB培养基和TB培养基下的生长曲线图
噬菌体是一类侵染细菌、放线菌等微生物的病毒,它们数量多、体积小、繁殖快、基因组可塑性高,是病毒中最为普遍和分布最广的群体。噬菌体污染具有多样性和顽固性特点,生物发酵类企业一旦出现噬菌体污染现象,若不及时处理,就会迅速扩散,甚至反复污染,造成不可估量的损失。
面对自然界存量远大于自己的噬菌体,细菌进化过程中,为了适应这种长期的生存压力,协同进化具备了多种防御噬菌体侵染的机制,于噬菌体侵染过程的不同阶段起作用,比如CRISPR系统、限制修饰(R-M)系统等(Tock Mark R,Dryden David T F,Thebiology ofrestriction and anti-restriction.[J].Curr Opin Microbiol,2005,8:466-72)。目前,工业上通过驯化筛选抗噬菌体菌株,因操作简单,效果显著而被广泛使用。但是目前各实验室和生产企业研究抗噬菌体大肠杆菌会有意识的进行时空分割,或者针对一种噬菌体的侵染进行研究,获得抵抗单一噬菌体的大肠杆菌,或者针对不同噬菌体的分别侵染进行研究,获得抵抗广谱噬菌体的大肠杆菌,而环境中噬菌体种类繁杂,同一时段、同一空间感染噬菌体往往并非单一类型,而是多种噬菌体共同爆发,这一污染现象我们可以称之为噬菌体群体爆发,而这些单一谱系和广谱的抗噬菌体大肠杆菌面对这种实际发酵生产场景中经常遇到的噬菌体群体爆发,效果甚微。
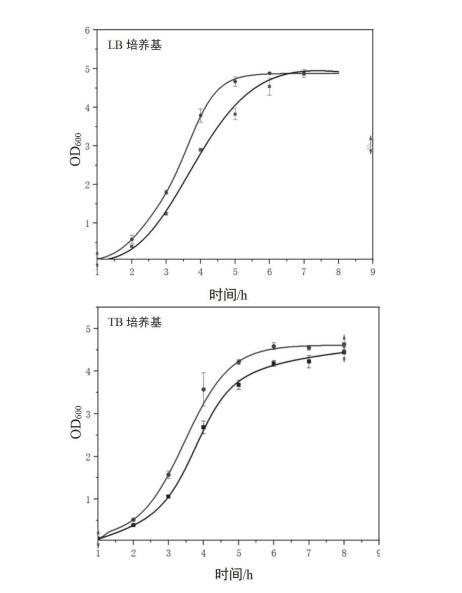
图为大肠杆菌E.coli PRE12(方形)和E.coli BL21(DE3)(圆形)在LB培养基和TB培养基下的生长曲线图;
实施:
多抗噬菌体菌株E.coli PRE12的抗噬菌体群体侵染能力和生长能力分析。
1.多抗噬菌体菌株E.coli PRE12的抗噬菌体性能分析。
(1)为了检测多抗噬菌体菌株大肠杆菌E.coli PRE12在噬菌体污染环境中的实际应用价值,进行抗噬菌体性能检测。具体步骤如下:挑取E.coli PRE12和E.coli BL21(DE3)单克隆,接种LB液体培养基(50mL/250mL锥形瓶),37℃,200rpm培养12h,分别取约1×109
个细胞加入5mL半固体LB培养基混匀,平铺在LB固体平板上层。室温放置5-10min,待凝固后,平板等分3个区域,分别滴加5μL稀释梯度为100、10-2、10-4的噬菌体样(6组噬菌体样,编号P01-P06,来源于污染噬菌体的生产车间和实验室,经NGS测序鉴定,每批爆发噬菌体污染的噬菌体种类众多且不同,其噬菌体类型涵盖I:dsDNA噬菌体;II:ssDNA噬菌体,起始噬菌体滴度约为108pfu/mL),做好标记,37℃培养12-24h,观察噬菌斑出现情况。
(2)结果如图8所示,相比较于E.coli PRE12平板的噬菌斑形成情况,不同组噬菌体样更容易在E.coli BL21(DE3)平板上形成噬菌斑,表明E.coli PRE12菌株面对广谱的复杂噬菌体环境,其抵抗噬菌体群体侵染能力增加了102-106倍,明显优于E.coli BL21(DE3),在噬菌体污染环境中具备潜在的实际应用价值。
2.多抗噬菌体菌株E.coli PRE12、大肠杆菌E.coli BL21(DE3)和ER2566(唯地生物,货号:EC1060)的抗噬菌体性能检测。
(1)市场上可以获得的具备噬菌体抗性的大肠杆菌表达宿主较少,ER2566具备T1噬菌体抗性,且被用于表达重组蛋白。为分析这三种表达宿主的抗噬菌体性能进行噬菌斑检测,方法同前,使用噬菌体样为生产过程中爆发的噬菌体样,编号P07和P08。经NGS测序鉴定,两组样品的噬菌体种类众多且不同,其噬菌体类型涵盖I:dsDNA噬菌体;II:ssDNA噬菌体,起始噬菌体滴度约为108pfu/mL。
(2)结果如图9所示,多抗噬菌体菌株E.coli PRE12具备显著优于E.coli BL21(DE3)和ER2566的抗噬菌体性能和应用潜力。
3.多抗噬菌体菌株E.coli PRE12生长曲线测定。
(1)测定E.coli BL21(DE3)和E.coli PRE12的生长曲线。具体步骤如下:将E.coliBL21(DE3)和E.coli PRE12分别接种于3mL LB新鲜培养基中,37℃,200rpm培养12h。次日分别取500μL于50mLLB培养基中(250mL锥形瓶),37℃,200rpm培养12h。培养至第0h、1h、2h、3h、4h、5h、6h、7h、8h时分别取样1mL,使用紫外分光光度计测定OD600。
(2)结果如图10所示,E.coli BL21(DE3)(圆形)和E.coli PRE12(方形)的细胞生长能力无明显差异。
4.多抗噬菌体菌株E.coli PRE12蛋白表达水平测定,具体步骤如下:
(1)重组蛋白表达质粒制备
为获得EGFP蛋白表达质粒,分别使用引物P01-F/P01-R扩增SEQ ID NO.7所示的DNA序列和引物P-VF/P-VR扩增pET-28a(+)获得线性化载体,使用上述一步克隆试剂盒将EGFP片段插入到pET-28a(+)中,得到pET-28a-EGFP重组蛋白表达质粒,引物见表格1。
(2)重组蛋白表达菌株构建
将EGFP蛋白表达质粒pET-28a-EGFP(目的蛋白携带His标签,29.2kDa)分别转化E.coli BL21(DE3)、E.coli PRE12和ER2566,获得EGFP的不同宿主的蛋白表达菌株。
(3)重组菌株诱导蛋白表达
挑取携带EGFP表达质粒的E.coli BL21(DE3)、E.coli PRE12和ER2566重组菌株单克隆分别接种3mL液体LB培养基(50μg/mL kan),37℃,200rpm培养12h。取500μL一级种子液,转接50mL液体LB培养基(250mL锥形瓶),37℃,200rpm培养10-14h。次日,取5mL二级种子液,转接500mL TB培养基(3L锥形瓶),37℃,200rpm培养至OD600
=1.2时,降温至25℃,使用终浓度0.5mM IPTG诱导表达12h。离心收集菌体,称取湿菌1g,使用PBS缓冲液,1:20破菌(1g湿菌对应20mL PBS),离心收集上清,沉淀使用20mL PBS重悬,分别制备40μL上清+10μL 5×上样缓冲液和40μL重悬沉淀+10μL 5×上样缓冲液两个样品,煮沸5min,进行SDS-PAGE电泳检测。结果如图11所示,E.coli PRE12的重组蛋白表达性能总体等同或优于E.coli BL21(DE3)和ER2566。
相关新闻推荐
1、江西李渡酒业特香型酒的酒曲微生物细菌标准及计数——摘要、材料与方法
2、羊奶或山羊奶中的乳清之开菲尔谷物的化合物代谢活动与生长变化
3、根际溶磷菌对牧草品种扁穗雀麦生长促进作用的机理——材料和方法、结果与分析
